呼吸科医生为啥总盯着嗜酸性粒细胞?
原创 OCRM2020报道小组 医学界呼吸频道 收录于话题#第四届东方呼吸病学术会议6个

嗜酸性粒细胞与多种肺部疾病相关,其中包括哮喘、嗜酸性粒细胞性肺炎、变应性支气管肺曲霉菌病等。然而,嗜酸性粒细胞与肺部疾病之间的关系尚未完全明了,其在不同肺部疾病中的具体作用机制还有待进一步研究。
在2020年9月11日召开的第四届东方呼吸病学术会议上,来自浙江大学医学院附属第二医院呼吸与危重症医学科的沈华浩教授向大家介绍了肺内嗜酸性粒细胞的稳态与致病。
作为中华医学会呼吸分会副主任委员兼哮喘学组组长,沈华浩教授团队这些年来一直致力于哮喘发病机制的研究,对嗜酸性粒细胞在肺部疾病,尤其是哮喘中的作用机制进行了深入的探索,取得了不错的研究成果。
嗜酸性粒细胞形态特征与功能
嗜酸性粒细胞(Eosinophils)最早于1879年由Paul Ehrlich发现,是一种胞浆内具有嗜酸性颗粒的粒细胞系白细胞。嗜酸性粒细胞由造血干细胞经多能造血干细胞-髓系祖细胞分化而来,IL-5是其分化过程中的关键因子[1]。
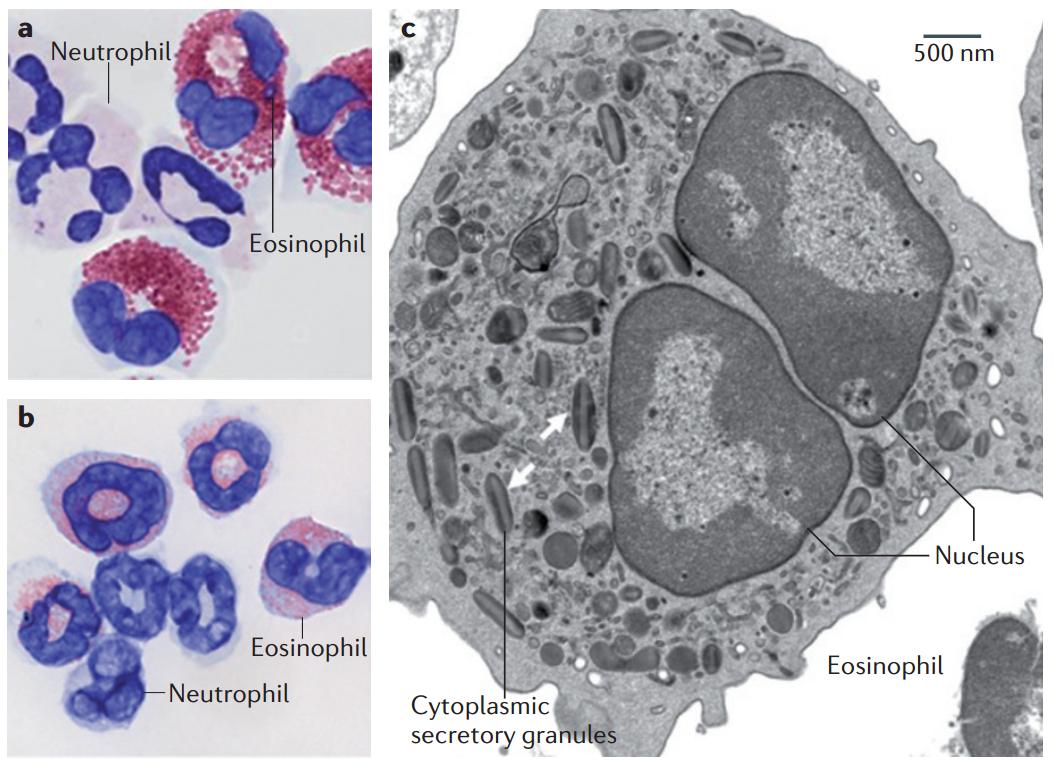
嗜酸性粒细胞主要存在于组织中,能够促进和抑制急性炎性反应,嗜酸性粒细胞参与对蠕虫感染、过敏和某些肿瘤的介导或应答反应。
嗜酸性粒细胞不仅是一种造血终端的炎症效应细胞,还是一种多功能免疫调控细胞。嗜酸性粒细胞的功能包括:多种免疫/炎症调控功能;抗原提呈作用;促进T细胞极化和活化;促进DCs成熟、肥大细胞脱颗粒;中性粒细胞、巨噬细胞活化;维持B细胞功能、浆细胞存活等。
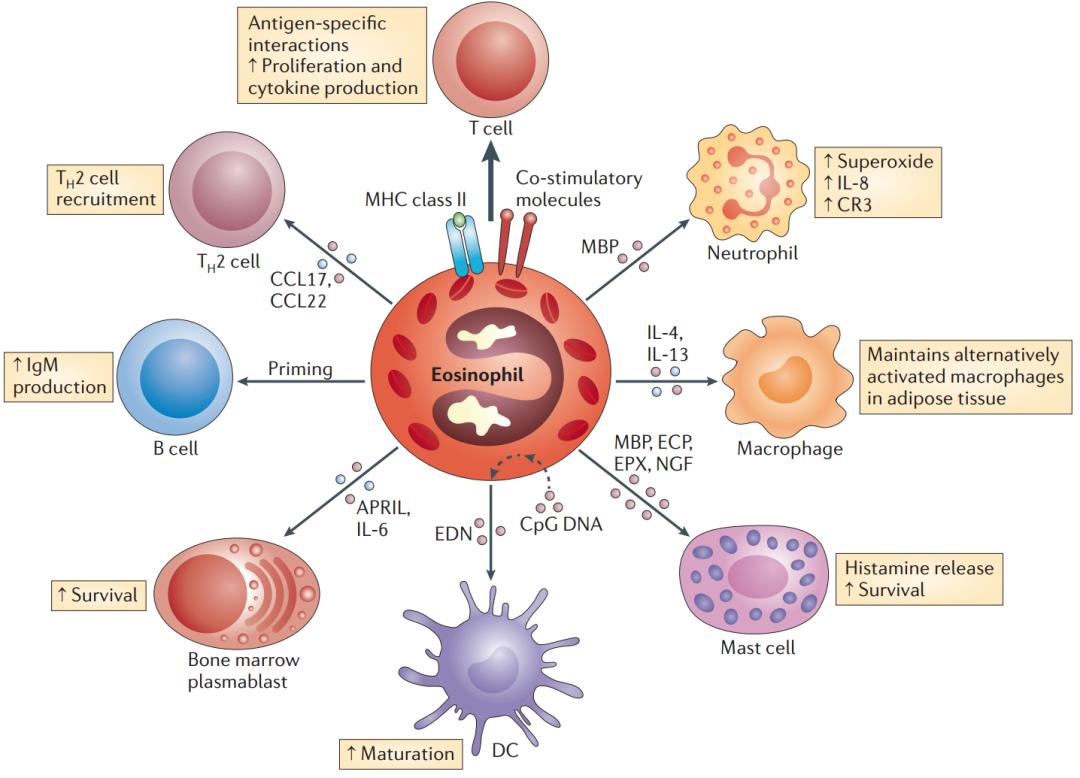
与中性粒细胞相似,它们具有吞噬作用,但主要功能是具有分泌作用的细胞,它们的诸多功能需要颗粒内容物的释放或细胞膜受到微粒或可溶性刺激物活化时的反应性产物。
嗜酸性粒细胞表面表达多种受体,介导细胞黏附、生长、激活、迁移和模式识别等。此外,嗜酸性粒细胞分泌多种细胞因子/趋化因子以及与颗粒蛋白释放有关的结构和颗粒蛋白成分。
嗜酸性粒细胞与造血稳态调控
哮喘是TH2型免疫反应为主的气道炎症性疾病,嗜酸性粒细胞迁移入肺导致炎症效应。
沈华浩教授团队这些年来以哮喘气道炎症为模型,探究嗜酸性粒细胞的功能,取得了一定的研究成果。
研究结果一:2008年发表的一项研究结果显示,哮喘小鼠骨髓造血干细胞(HSC)增殖水平增加,但体外HSC造血重建功能下降。该研究首次在哮喘小鼠中发现HSC增殖水平增加以及造血重建功能降低的现象。
研究结果二:在上述研究结果的基础上,进一步研究发现HSC稳态与功能的损伤依赖于嗜酸性粒细胞数目的增加,嗜酸性粒细胞数目的增多导致HSC功能的耗竭。
研究结果三:2018年发表在Cell Research上的一项研究[2]结果发现,HSC稳态与功能的损伤依赖于嗜酸性粒细胞分泌。嗜酸性粒细胞分泌CCL6,一方面损伤HSC的功能,另一方面促进HSC增殖、分化,介导哮喘气道炎症。
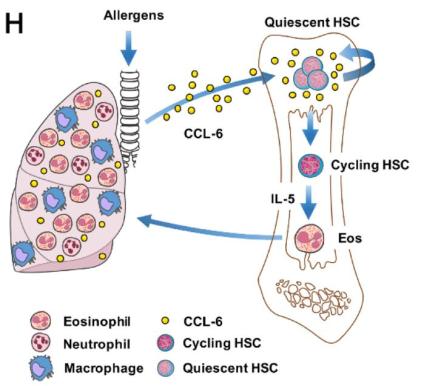
沈华浩教授总结道,上述一系列研究成果显示嗜酸性粒细胞直接作用于HSC,破坏造血稳态,正反馈调控气道炎症。其中,CCL6在嗜酸性粒细胞介导的气道炎症反应中发挥了重要作用,在此基础上,沈华浩教授团队进一步研究了CCL6参与哮喘气道炎症的作用机制。
研究结果一:哮喘患者中CCL6同源物CCL23和CCL15升高,主要由嗜酸粒细胞产生,是哮喘患者的特异性生物标志物。
研究结果二:小鼠哮喘模型中嗜酸性粒细胞分泌CCL6增加。
研究结果三:CCL6基因敲除对哮喘炎症有显著保护作用。
研究结果四:CCL6影响哮喘气道炎症中嗜酸性粒细胞增殖分化。CCL6敲除后,HSC向嗜酸性粒细胞分化受阻断。
基于以上研究,沈华浩教授表示嗜酸性粒细胞分泌的CCL6调控TH2反应、谱系分化以及气道炎症。CCL6-CCR1调控机制的发现,为建立潜在哮喘药物治疗靶点提供了研究依据。
嗜酸性粒细胞对ARDS的意义
除了哮喘,嗜酸性粒细胞还参与了其他肺部疾病的发生发展,而嗜酸性粒细胞与急性肺损伤(ALI)之间的关系尚不明确。研究发现,存活的ALI患者肺部嗜酸性粒细胞增多,但嗜酸性粒细胞在ALI中的作用机制尚未阐明。
沈华浩教授团队对嗜酸性粒细胞在ALI中的作用机制也进行了一系列研究,取得了不错的研究成果。
研究结果一:LPS诱导的急性肺损伤模型早期,嗜酸性粒细胞先于中性粒细胞聚集于肺部(0.5h vs 3h)。这表明ALI早期肺部一过性嗜酸性粒细胞增多,且早于中性粒细胞募集。
研究结果二:嗜酸性粒细胞缺失的小鼠ALI早期缺乏嗜酸性粒细胞聚集,其肺部炎症更加明显。这表明ALI早期肺部一过性嗜酸性粒细胞增多对气道炎症具有保护作用。
研究结果三:肺部CD101-嗜酸性粒细胞保护ALI炎症,而CD101+嗜酸性粒细胞加剧炎症。气道炎症中的嗜酸性粒细胞主要为CD101+,不同CD101表达的嗜酸性粒细胞过继实验提示CD101+嗜酸性粒细胞具有致病性。
研究结果四:沈华浩教授今年发表在Eur Respir J上的一项研究[3]揭示了外周血嗜酸性粒细胞计数与ARDS患者转归的关联。该研究结果显示,嗜酸性粒细胞数目较高的ARDS患者倾向于存活。
嗜酸性粒细胞与新冠肺炎探究
大会上,沈教授特别介绍了上海交通大学附属上海市第一人民医院张旻教授团队发表在Allergy上的研究成果。
▎COVID-19肺炎的早期诊断障碍
大多数COVID-19患者早期缺乏特征性表现,COVID-19患者可出现白细胞与淋巴细胞的减少,与既往SARS和MERS感染表现类似,且与流感等其他病毒性呼吸道感染难以区别。
15%-20%患者会在发病第8天左右,迅速进展至危重症,早期识别疾病的重症倾向,是降低病死率的关键。
▎嗜酸性粒细胞在COVID-19辅助确诊中的预测价值
COVID-19患者嗜酸性粒细胞减少的发生率明显高于COVID-19疑似患者、流感肺炎患者以及其他类型肺炎患者[4]。外周血嗜酸性粒细胞计数联合中性粒细胞/淋巴细胞比值(NLR) ,对COVID-19的预测价值更高(ENL模型)。
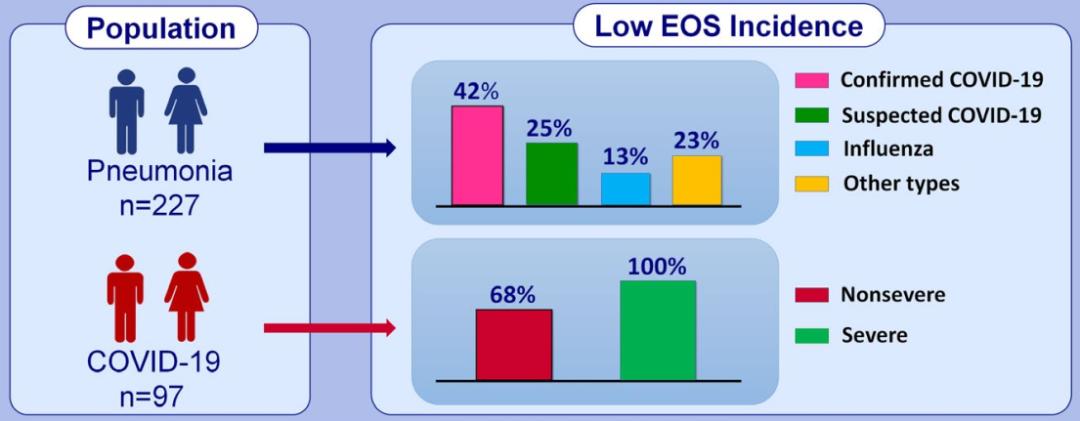
▎嗜酸性粒细胞降低对COVID-19重症的提示
所有重症COVID-19患者嗜酸性粒细胞计数均低于检测下限,入院时嗜酸性粒细胞计数低的患者比嗜酸性粒细胞计数正常者更易出现发热、疲劳、呼吸急促等症状,CT病灶更多且进展风险高,住院时间和总病程延长。
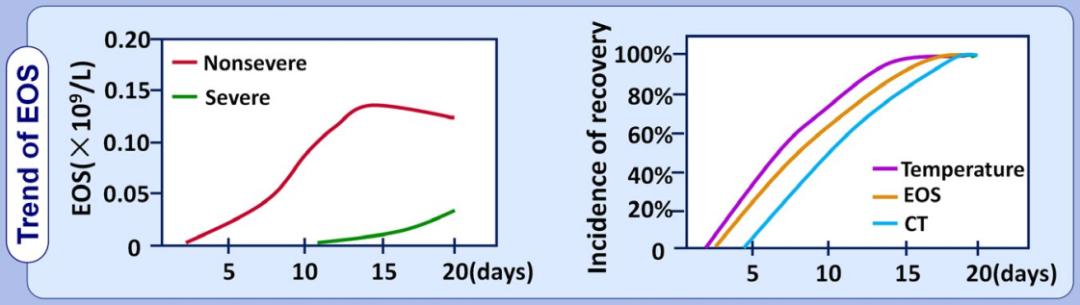
基于上述研究,沈华浩教授指出嗜酸性粒细胞与新冠肺炎的诊断及病情转归有着重要关联,需要再次思考糖皮质激素在COVID-19患者,尤其是重症患者中使用的利弊。
最后,沈华浩教授总结了嗜酸性粒细胞新功能的探究成果:
嗜酸性粒细胞通过影响造血稳态调控哮喘炎症;
嗜酸性粒细胞在ALI/ARDS中的潜在保护机制;
嗜酸性粒细胞对于COVID-19肺炎的诊断意义。
专家简介

浙江大学呼吸疾病研究所所长,浙江大学医学院附属二院呼吸与危重症科主任,浙江省呼吸疾病诊治研究重点实验室主任,中华医学会呼吸病学分会副主任委员,中国医师协会呼吸医师分会副会长,哮喘与变态反应工作委员会主任委员,海峡两岸药卫生协会呼吸专委会主任委员,教育部长江学者特聘教授,国家杰青获得者。
在慢性气道疾病分子发病机制和诊治新技术等方面取得突出成绩,首次命名哮喘新的类型-胸闷变异性哮喘,提出细胞分裂新理论。以第一完成人获国家科技进步二等奖、省部级一等奖多次。发表论文350余篇,其中SCI收录130余篇,总影响因子大于1000。其中以第一或通讯作者含(共同)在Nature,NEJM,Lancet,JAMA,JACI,AJRCCM,Cell Research,Autophage等权威期刊发表SCI收录论文90余篇,总影响因子超过900。
参考文献:
1.Rosenberg H, Dyer K, Foster P. Eosinophils: changing perspectives in health and disease. Nature reviews Immunology. 2013;13(1):9-22.
2.Zhang C, Yi W, Li F, et al. Eosinophil-derived CCL-6 impairs hematopoietic stem cell homeostasis. Cell research. 2018;28(3):323-335.
3.Zhu C, Weng Q, Zhou L, et al. Homeostatic and Early Recruited CD101 Eosinophils Suppress Endotoxin-induced Acute Lung Injury. The European respiratory journal. 2020.
4.Xie G, Ding F, Han L, Yin D, Lu H, Zhang M. The role of peripheral blood eosinophil counts in COVID-19 patients. Allergy. 2020.
本文首发:医学界呼吸频道
报道及审核专家:浙江大学医学院附属第二医院呼吸与危重症医学科的沈华浩教授
本文报道:OCRM2020报道小组-小布
原标题:《呼吸科医生为啥总盯着嗜酸性粒细胞?》

