三光子成像:大脑深处的“勘探器”
原创 长光所Light中心 中国光学
撰稿 | 华子杰(哈尔滨工业大学 博士生)
三光子显微镜(3PM)作为一种新兴的非线性光学成像技术,开始被用于活体小鼠脑部神经细胞的形态和功能研究,为活体生物的病理学(如阿尔兹海默症)和活体生物神经细胞的钙动力学研究提供宝贵的观测工具。
近期,美国康奈尔大学的Chris Xu(
拓展链接:人物介绍)课题组对近年来3PM的发展及应用进行综述,比较了2PM和3PM的优缺点,并归纳了3PM系统的参数优化,最后阐述了用于体成像的不同显微方案。该综述以“Three-photon neuronal imaging in deep mouse brain”为题发表于光学顶刊Optica。
大脑,对于人类来说依然是一个未解之谜,对大脑的研究,或许能帮助人类打破传统生物医学的瓶颈。脑神经观测对人类了解情感与记忆的组成,探索高级脑功能机制以及对脑疾病的诊疗起着重要作用。现如今,对大脑的探索主要依赖光学显微成像。然而,神经组织对光的散射使得光束无法在脑内传播较深距离,成像深度的不足严重阻碍了大脑神经成像质量。由于。因此,如何实现大脑深度成像成为了脑神经成像的重要研究热点。
多光子显微成像技术的出现一定程度上缓解了成像深度不足的挑战。多光子成像基于多光子激发效应,原理示意图如图1。荧光分子存在分立能级,能量最低的能级称为基态,大多分子处于此能级,能量较高的能级称为激发态。若存在特定波长的照明光,可以使处于基态的电子吸收若干光子,并跃迁到激发态,这些光子在激发态停留一定时间后再次弛豫震荡跃迁回基态,并产生一个对应波长的光子。若入射光波长较长,则可能使基态的分子同时吸收多个光子,即多光子激发。

a、双光子激发;b、三光子激发
在过去的30年中,双光子显微镜(2PM)的出现大大加速了大脑成像的研究进程,它具有极高空间分辨率和大脑深层成像的能力。然而,2PM成像深度被限制在几十至几百微米,想要在更深的毫米量级的生物组织中进行荧光成像,便需要发展出其他成像技术。
三光子显微镜(3PM)的概念于1996年被提出,利用该技术有望将荧光成像深度进一步拓展。它利用了三光子激发效应,荧光分子吸收三个长波长光子,并通过辐射跃迁释放一个荧光光子。然而由于3PM需要极高的激发脉冲功率,并且需要发展并不成熟的长波段激光器作为光源,所以并未得到广泛的关注。然而近年来,人们验证了深度脑成像的最佳激发波长在1300 nm和1700 nm左右,对于大多数现有荧光探针的双光子激发(2PE)来说太长了。此外,高阶非线性效应与2PE相比可提供更高非线性阈值,这对于散射介质的高对比度成像是必不可少的。这两个发现激起了3PM的研究热潮,并将其应用于深度生物组织成像、脑活动记录及神经生理学等领域的研究。
文章综述了3PM成像系统的种类和应用领域。利用3PM进行脑成像的一项主要目的便是记录神经活动,而神经元成像的目标是在组织发热和非线性损伤的限制范围内,最大化记录神经元的数量,这就要求3PM系统需要实现较深位置的高信噪比荧光成像。幸运的是,长波长3PM的主要优势便是深度成像和高散射层成像。然而两种应用都需要照明激光在大脑表面具有高功率,因此,在试图提高成像体积率的同时保持信号产生效率至关重要。
一般而言,3PM基于点式扫描进行成像,激光束聚焦于样品一点对其荧光强度进行记录,通过振镜或是移动样品台扫描逐点整个样品。因此,对三维生物组织体成像需要耗费大量的时间,限制了其测量神经活动的能力。因此,众多研究将矛头指向了如何改进成像系统以提高体成像速率。
如今,三光子快速成像的显微方法主要分为两大类:非点式扫描成像和多平面多焦点成像。非点式扫描成像技术主要包括:时间聚焦、贝塞尔光束照明和三光子光片显微镜等。而多平面多焦点成像技术主要为:远程聚焦方案。各种系统方案示意图如图2所示。
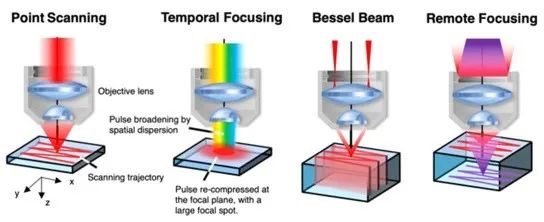
图源:Optica vol.7: 947-969 Fig.7
1. 非点式扫描成像
第一种非点式扫描3PM为三光子时间聚焦显微镜(TF-3PM)。研究表明,时间聚焦具有实时聚焦光的能力,可通过微米轴向限制和通过散射组织的鲁棒性传播来对样品的大表面积进行无扫描照明。时间聚焦3PM中,成像采用宽场显微成像,激发光照明范围为较大或全部区域的样品。接着采用时间聚焦技术,利用放置在与物镜焦平面共轭平面中的扩散或色散光学元件来产生与位置相关的时间脉冲展宽,从而实现轴向受限的多光子吸收,而无需进行严格的空间聚焦。用时间聚焦的宽场照明代替点扫描消除了点式扫描成像时间分辨率不足的缺陷,对于脑神经快速体成像的研究有着重要的意义。利用该技术,已成功实现了活体及离体的深度快速体成像。然而成像过程需要使用一维或二维相机,限制了成像深度。
为了有效拓展焦深的同时维持显微镜的横向分辨率,有研究人员提出了贝塞尔光束照明的3PM。由于在轴向上的荧光激发是同时的,因此该技术获得了样品的轴向投影图像,并且无需进行轴向扫描。因此,它对稀疏标记的样本成像效果最佳。然而该方案由于荧光分子在轴向上的重叠而无法对较大视场区域成像,并且由于高阶非线性效应对于贝塞尔光束旁瓣的抑制较高,不可避免地存在荧光激发效率低的问题。与贝塞尔光束照明类似的是三光子光片显微镜,它使用细长的高斯光束或贝塞尔光束在垂直于照明光束的方向上扫描样品。然而它需要较高的激发光功率,限制其活体成像的应用空间。并且,类似于TF-3PM,该方案还需要使用相机成像,限制了其组织穿透能力。
总的来说,非点式扫描成像系统通过改变照明光束的形状以扩展激发样品体积,在提升成像速率的同时,会牺牲荧光激发效率或是空间分辨率,尤其轴向样品信息很难得到分辨,因此大多用于对大脑浅层神经进行成像。
2. 多平面多焦点成像
非点式扫描3PM最大的缺陷是它的轴向不可区分性。为了实现轴向的分辨,并同时实现快速的体成像,2019年有研究者提出了双平面3PM方案,在活体组织600μm深度处对两个平面内的钙离子进行成像,将体积成像速率提升了一倍。在此基础上,配合多个反射镜和远程聚焦技术,可以使用时分复用激发从不同的成像体积实现并行采集。如今,远程聚焦已是最成熟的显微技术,可提供3PM的轴向扫描能力。
尽管3PM的成像系统逐渐发展得多样化以满足不同成像需求,每种成像方式有自身独特的优势和不足,但是由于三光子激发,它们均存在共性的优缺点,主要体现在两个方面:长波段激发和高阶非线性效应。
在综述中,3PM相较于2PM的优缺点比较被归纳于图3。首先相对于2PM而言,3PM的激发波段更长,约为1300nm至1700nm之间。长波段激发光的使用减少了介质的光散射,这使得生物组织介质对于光波的损耗减少,从而成像所需的激发光强要求降低。一般来说,我们定义光束衰减1/e时传播的距离为有效衰减长度(EAL),它衡量了介质的损耗,反映了为使焦点处荧光信号稳定,激发光功率成像深度呈指数增长的速率。以小鼠新皮层为例,3PM使用的1300nm激发照明下EAL约为300μm,而2PM使用的920nm激发光下EAL只有150μm,这意味着成像深度每增加300μm,3PM的光衰减较2PM减少e倍。
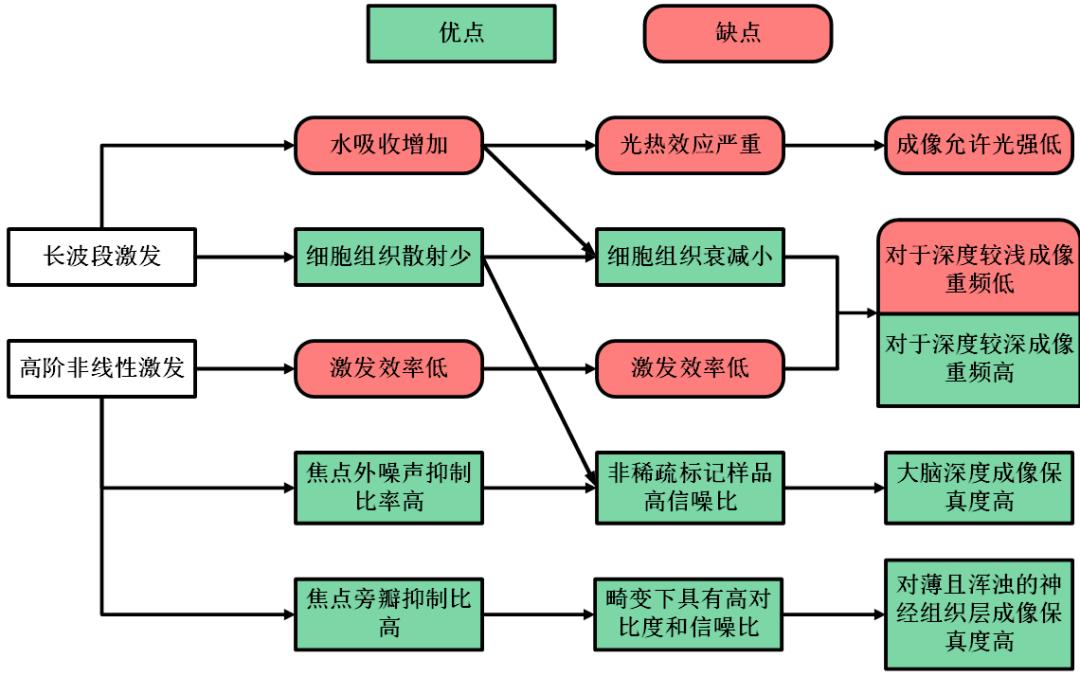
图源:撰稿人整理并编译
源自:Optica Vol. 7, Issue 8, pp. 947-960 (2020) Fig.1
并且,长波段同样会带来更高的成像信噪比。多光子成像信号背景噪声包含两个部分,一是体背景噪声,即离焦光束产生的荧光噪声;二是散焦背景噪声,来源于焦点处点扩散函数的旁瓣产生的荧光噪声(如图4)。其中体背景噪声强度主要取决于归一化的成像深度(即物理深度除以EAL)以及焦点体积中的染色密度与散焦中的染色密度之比。3PM由于有较大的EAL,受体背景噪声影响较小,有效地提高了成像的信噪比。
其次,3PM利用了更高阶的非线性效应,一方面抑制了点扩散函数旁瓣的大小,有效抑制成像过程中的散焦背景噪声,另一方面使得离焦光束由于强的衰减不容易产生三光之子激发,从而产生荧光噪声。因此,更高的非线性阶数同样为3PM成像结果带来更高的信噪比。
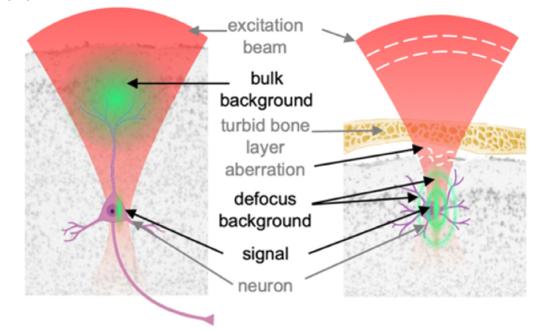
图源:Optica vol.7: 947-969 Fig.3
总的来说,深散射组织中的高空间分辨率荧光成像具有挑战性,实现难度随着成像深度的增加呈指数增长。长波长3PM克服了2PM的某些局限性,实现了深度更深的成像。尽管在过去的三十年中,荧光显微镜的成像深度已大大增加,这主要是由多光子显微镜的创新推动的,但即使是最深的3PM成像也无法穿透体内成年小鼠大脑的四分之一。因此,如何继续拓展成像深度,将成为进一步需要解决的挑战。
文章信息
Optica Vol. 7, Issue 8, pp. 947-960 (2020)
论文地址
https://doi.org/10.1364/OPTICA.395825
【】
公众号时间轴改版,很多读者反馈没有看到更新的文章,据最新规则,建议:多次进“中国光学”公众号,阅读3-5篇文章,成为“常读”用户,就能及时收到了。
欢迎课题组投递成果宣传稿
转载/合作/课题组投稿,请加微信:447882024
Banner 区域
往期推荐
走进新刊
开 放 投 稿:Light:Advanced Manufacturing
ISSN 2689-9620
期 刊 网 站:www.light-am.com
敬请期待
新 刊:eLight
ISSN 2662-8643
即 将 隆 重 上 线

【】
原标题:《三光子成像:大脑深处的“勘探器”》

