文献精读 | 激活神经病理性疼痛下行调控的神经环路
原创 刘婷婷 山中麻署

人类背侧前额叶皮层(dlPFC)在疼痛的认知和情感调节中起重要作用,刺激该区域有助于急性疼痛的调节和慢性疼痛的治疗。啮齿类内侧前额叶皮层(mPFC)是灵长类dlPFC的同源体。小鼠周围神经损伤后, PV+的GABA能中间神经元 (PVIN)对mPFC输出的抑制增强,导致mPFC输出减少。使用光遗传学的方法抑制PVIN可以达到镇痛,并逆转了与神经病理性疼痛相关的位置回避和逃避行为。该现象在细胞、分子和网络层面是如何发生的尚不清楚。mPFC与杏仁基底外侧核(BLA)相互连接,BLA通过臂旁核接收来自脊髓的上行感觉输入,这提示观察到的mPFC功能改变可能源于BLA输入。本研究使用光遗传学方法来检验特定谷氨酸能BLA输入mPFC的作用,揭示mPFC信号处理失调的分子基础,并阐明涉及慢性神经病理性疼痛状态的下游大脑回路。
1、神经损伤引起BLA向mPFC输入的失调
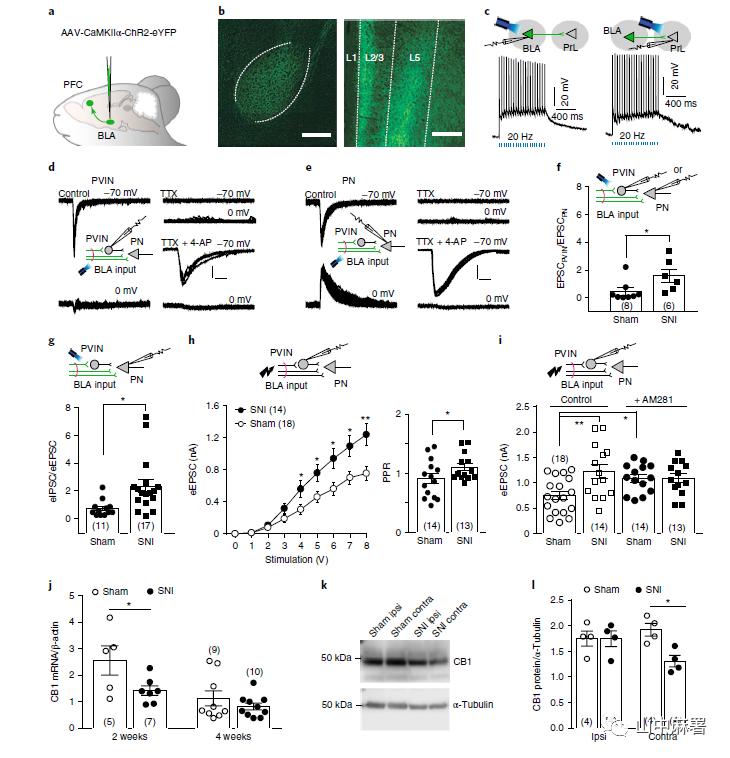
作者首先通过PV-cre小鼠和cre依赖的Ai9-tdTomato报告子小鼠(PV cre::Ai9)进行杂交来标记PVIN,从而实现对脑片中mPFC区已标记的第5层PVIN和未标记的锥体神经元的突触后电活动进行标记。运用病毒学的方法,在BLA的投射神经元中表达ChR2(H134R)-eYFP (图1a),从而可以选择性地激活来源于BLA的输入。由于mPFC的主要输出区在皮质第5层,所以本研究主要观察该区域。
电流钳记录显示,蓝色激光脉冲可以在病毒转染的BLA神经元和接受BLA输入的mPFC第5层神经元中触发动作电位(图1c)。对PVIN进行电压钳记录显示,当膜电压在-70mV时,蓝色激光诱导兴奋性突触后电流(eEPSC)(图1d)。这些eEPSC可被钠离子通道阻滞剂(TTX)阻断,同时钾通道阻滞剂(4-AP)可以逆转这种阻断效应(被认为与促进钙内流从而易化突触前囊泡的释放有关)(图1d)。这与BLA向PVIN输入的单突触特性一致。此外,小幅的抑制性突触后电流(eIPSC)在使用TTX后消失,并且加用4-AP并不能使其恢复,这提示该电流具有双突触特性。同样,在第5层锥体神经元(谷氨酸能投射或PN)中得到相似的结果:电压钳记录到蓝光诱导的eEPSC和eIPSC,两者都能被TTX消除(图1e)。4-AP只能恢复兴奋性电流,而GABA能神经元介导的突触前馈抑制不能恢复。因此,输入mPFC的谷氨酸能BLA与PVIN和PN形成单突触连接。
鉴于BLA直接或者间接通过PVIN投射到PN,所以阐明这些突触输入对整体PN输出的作用非常重要。作者在AAV (ChR2 (H134R))注入BLA后7-10周,在假手术组或SNI(神经病理性疼痛模型)小鼠的同一大脑切片中,记录mPFC第5层中成对的PN和PVIN受蓝色激光(473nm,3-5 mW)诱导的最大eEPSC。与假手术组相比,SNI小鼠的eEPSC-PVIN: eEPSC-PN比增加(图1f),这提示神经损伤增强了对GABA能中间神经元的兴奋性输入,从而介导其对PN的前馈抑制。由于第5层PN整合了自身收到的兴奋性和抑制性输入后才将输出信号发送到其他皮层和皮层下区域,因此这些神经元兴奋和抑制的相对平衡对于确定其总体活动至关重要。第5层PN接收来自多种来源的输入,并保留在制备的切片中。因此,通过记录第5层PN中被蓝光诱发的最大eEPSC和eIPSC来比较直接来自于BLA的谷氨酸能输入与来自BLA经由不同部位PVIN的GABA能输入(前馈抑制)。研究结果表明,神经损伤导致兴奋性事件的抑制作用增强(图1g),从而导致潜在的mPFC输出的净抑制。
为进一步溯源可塑性的变化,作者对源自BLA的纤维束进行了电刺激,并对mPFC切片中的第5层PVIN进行了记录。与假手术小鼠相比,SNI动物的PVIN中eEPSC的振幅增加(图1h左)。同时,SNI动物的神经元的配对脉冲易化(PPR)也发生了改变(图1h右)。这些数据表明,神经损伤增加了BLA输入和mPFC PVIN之间的突触强度。大麻素在控制GABA释放中起作用并且大麻素受体1(CB1)存在于谷氨酸能传入神经中。因此使用CB1受体拮抗剂AM281来明确大麻素信号是否是神经损伤诱导的突触输入改变的基础。AM281的应用选择性地增加了假手术组小鼠中的突触输入,使其达到与SNI小鼠相似的水平(图1i)。相比之下,AM281对SNI小鼠没有影响(图1i),说明神经损伤后大麻素信号减弱。定量PCR和Western blot分析显示,SNI小鼠mPFC中 CB1受体 (图1j,图1k,l)水平下调。综上,神经损伤导致mPFC第5层的内源性大麻素信号减弱,不能抑制来自BLA的谷氨酸能输入PVIN。
2、BLA-mPFC输入在神经病理性疼痛中的功效
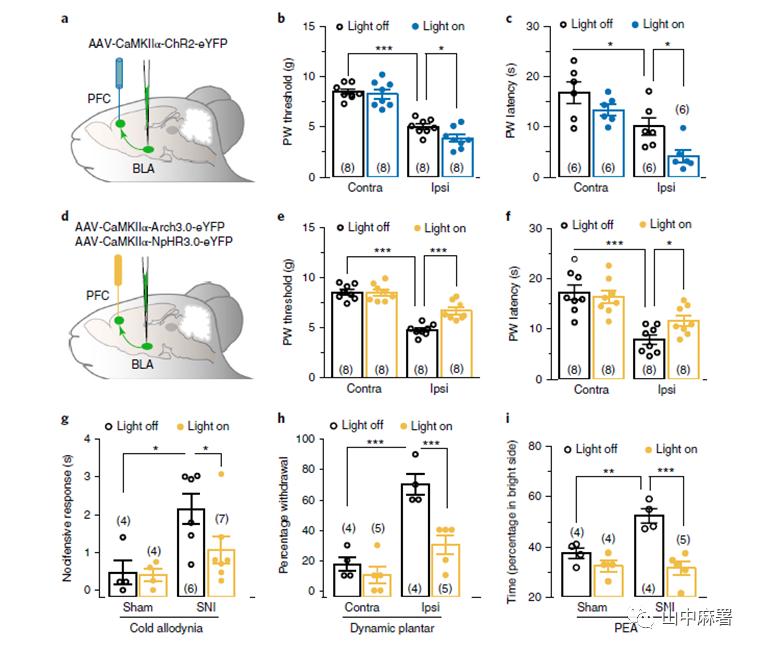
使用光遗传学的方法,在BLA中注射病毒,使视蛋白在mPFC中表达(图1a、b)。使用蓝色激光(10Hz, 5-10 mW)激活BLA的输入 (图2a)可显著增强SNI小鼠的机械和热痛觉过敏 (图2b, c),但不改变假手术组小鼠的反应。通过病毒注射的方法,在BLA中注入抑制性视蛋白(Acrh3.0, NpHR3.0) (图2d),结果显示黄光抑制SNI小鼠的机械和热痛觉过敏,但对假手术动物无影响(图2e,f)。Arch3.0介导的抑制BLA-mPFC投射作用对于冷痛觉超敏(图2g)和动态足底触觉超敏(图2h)模型中产生镇痛作用,逆转SNI小鼠对机械刺激后爪的逃避/回避(PEA)反应(图2i)的同时不影响运动活动。c-fos染色进一步支持了以上光遗传学实验的结果。总之,以上数据表明,周围神经损伤改变了从BLA到mPFC的突触输入,并且该回路的光遗传学操作可调节疼痛的感觉和情感成分。
3、mPFC到PAG的投射
mPFC输出的改变对疼痛相关的神经轴有何影响?
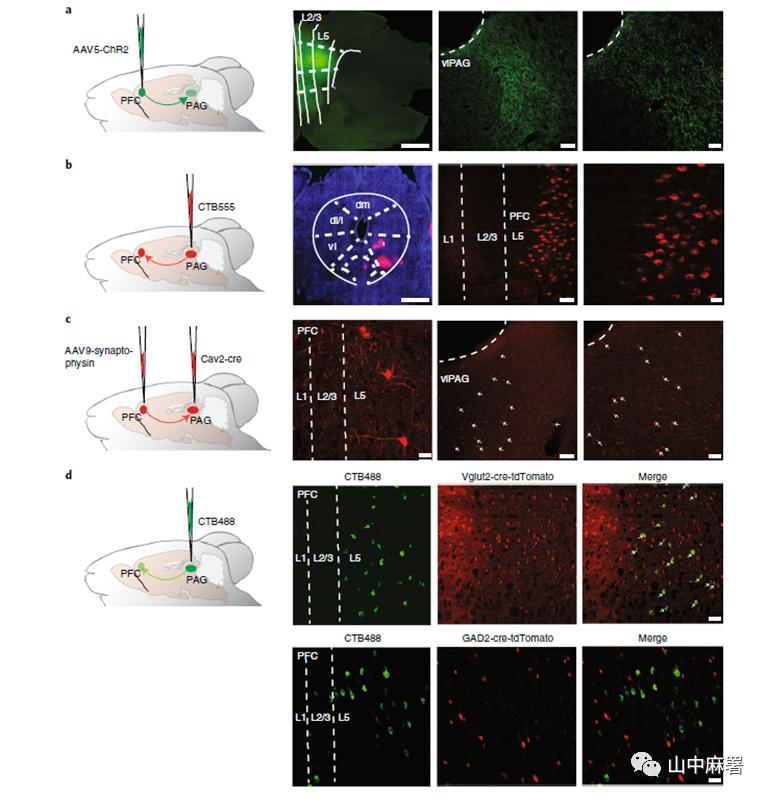
PAG是在疼痛信号下行通路中是一个非常重要的结构,其中谷氨酸能和GABA能神经元介导相反的效应。PAG接受来自PFC的投射,但是他们之间的连接如何调节疼痛的过程不得而知。使用前述方法,将AAV5-CaMKIIα-ChR2 (H134R)-eYFP注射到mPFC第5层,检测PAG区的YFP表达,结果显示mPFC第5层主要投射到后腹外侧 (vl) PAG区域(距前囟约-4.6 至- 4.8 mm)(图3a)。逆向标记也确定了两者之间的投射关系(图3b)。此外,通过将AAV9-hEF1α-DIO-synaptophysin-mCherry病毒注入缘前mPFC第5层,同时将Cav2-cre逆转录病毒注入vlPAG,进一步证实了直接mPFC-vlPAG投射的存在(图3c)。为明确从缘前mPFC到vlPAG的投射的特征,作者分别将Vglut2-cre和GAD2-cre转基因小鼠与Ai9 tdTomato报告子小鼠杂交。将CTB488注射到vlPAG中,结果证实从mPFC到vlPAG的投射神经元是谷氨酸能而非GABA能(图3d)。此外,作者发现来自mPFC的谷氨酸能投射支配vlPAG中的CaMKIIα阳性投射神经元和GABA能神经元。
4、mPFC-PAG连接在神经病理性疼痛中的作用
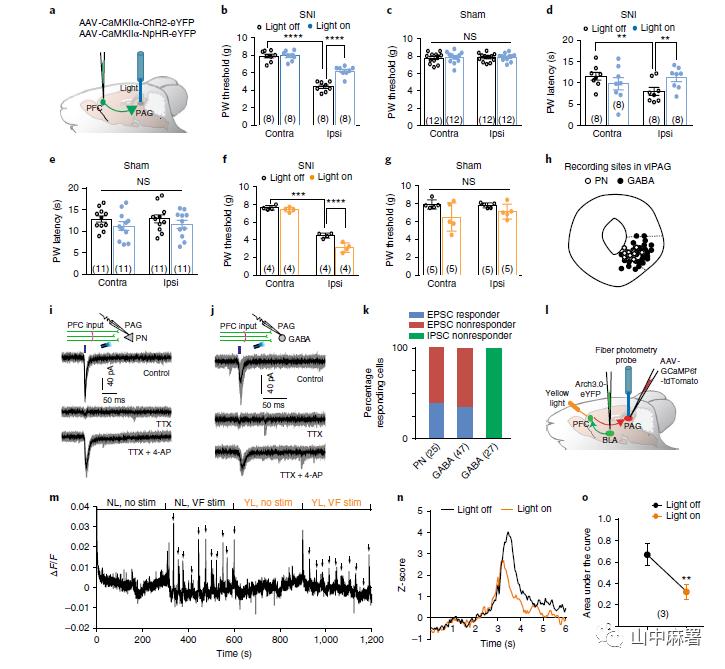
为了确定这些谷氨酸能mPFC-vlPAG投射如何调节伤害性感受反应,作者将AAV5-CamKIIα-ChR2(H134R)-eYFP注入mPFC第5层,并在vlPAG中植入光纤(图4a)。使用蓝光(473 nm, 20Hz和5-10 mW)激活vlPAG中的谷氨酸能投射可以抑制SNI小鼠同侧爪的机械和热痛觉过敏,对于对侧爪子或假手术组小鼠(图4b-e)无影响。作者还研究了mPFC-vlPAG投射中表达抑制性视蛋白NpHR3.0是否可以增强疼痛反应。正如预期,在vlPAG中使用黄光(589 nm,固体光,5 mW)处理后,SNI小鼠同侧的机械阈值降低了(图4f,g),从而加重神经病理性疼痛。综上,这些数据表明,增强对mPFC中PN的前馈抑制降低了mPFC-vlPAG投射的活性并加剧了疼痛反应,而通过光遗传学促进这些投射神经元的放电具有镇痛作用。
5、mPFC输入vlPAG区的信号处理
为确定mPFC的谷氨酸能输入在vlPAG中如何作用,作者在PrL注射 AAV-ChR2的小鼠脑切片中对vlPAG区进行了电生理记录(图4h,i,j)。激活mPFC的谷氨酸能投射可以在vlPAG内的谷氨酸能(图4i)和GABA能(图4j)细胞中激发突触兴奋性活动。由于4-AP可以恢复TTX处理后的突触该改变,因此这些属于单突触连接。在vlPAG中分别有约40%和36%的谷氨酸能和GABA能细胞中可以观察到光诱发的谷氨酸能输入(图4k),这表明并非vlPAG中的所有细胞都接受了来自mPFC的直接输入。与脑片的电生理结果一致,在体的光遗传学研究显示,激活mPFC-vlPAG投射后vlPAG内谷氨酸能神经元中c-fos表达增加。抑制BLA-mPFC后,在vlPAG中也观察到相似的改变。另一方面,激活mPFC-vlPAG的谷氨酸能投射后,GABA能细胞中c-fos表达的意外下降。对此现象可以做如下解释:存在两个GABA能细胞群——一个直接从mPFC接收谷氨酸能输入, 在ChR2刺激下其活性会增加;另一个细胞群可能会接收前馈GABA能抑制,导致c-fos表达的总体下降。在脑片记录中,27个GABA能细胞中,没有一个显示eIPSC(图4k),表明在这些GABA神经元中不存在功能性GABAA受体。综上,mPFC向vlPAG投射对GABA能和谷氨酸能细胞产生不同的效应。
为了进一步实时在体观察vlPAG中神经元活性的变化,作者使用纤维记录系统研究可自由活动的SNI小鼠中GABA能细胞的活性(图4l)。使用GAD2-cre小鼠,在vlPAG区GABA能神经元中表达GCaMP6f和tdTomato, Arch3.0在BLA-mPFC投射中单独表达。如图4m-o所示,刺激后爪触发了vlPAG GABA能细胞中的钙荧光强度短暂的升高。同时抑制BLA-mPFC (即增加mPFC向vlPAG的输出)导致vlPAG中诱发的钙瞬变减少,这与前述GABA能细胞的c-fos减少相一致。
6、消除mPFC -vlPAG的投射
为了排除抑制BLA输入mPFC产生镇痛作用涉及其他(平行)通路的可能性,通过双重注射AAV-mCherry- flex-dtA和Cav2-cre病毒选择性消除该通路中的投射。这导致白喉毒素亚基 A (dtA)仅在连接两个注射的大脑区域的神经元中表达,因此被消融。向在BLA至mPFC投射中表达Arch3.0的SNI小鼠缘前mPFC中注射AAV-mCherry-flex-dtA,向vlPAG中注射Cav2-cre病毒,然后将光纤套管植入缘前mPFC中(图5a)。该过程大大减少了缘前mPFC第5层中神经元数量(图5b,c),并降低了BLA-mPFC输入产生的镇痛效应(图5d),这表明mPFC-vlPAG投射是BLA-mPFC控制疼痛反应不可或缺的下游通路。
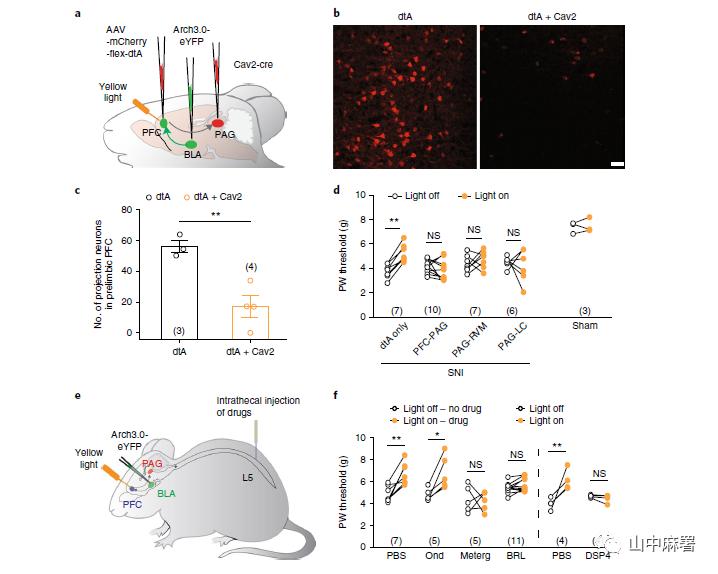
7、BLA-mPFC-PAG连接与下行性疼痛调节之间的联系
PAG经由延髓头腹内侧区(RVM)和蓝斑(LC)投射到脊髓,对疼痛进行下行调节。vlPAG向LC和RVM发出GABA能和谷氨酸能投射。消除vlPAG到LC或vlPAG到RVM的投射可以逆转BLA-mPFC阻断而产生的镇痛作用(图5d),表明这两种途径都是mPFC自上而下控制神经病理性疼痛所必需的。值得注意的是,从PAG到LC和RVM的疼痛信号分叉也与阿片类镇痛有关。
RVM和LC分别向脊髓发送下行的5-羟色胺能和去甲肾上腺素能投射。使用光遗传学与体内药理学相结合(图5e)的方法来确定这两条通路如何参与BLA介导的疼痛信号调节。分别在BLA-mPFC正常以及抑制(Arch3.0介导)的情况下测量机械阈值。此外,在鞘内注射空白载体、5-羟色胺(5-HT3)受体拮抗剂昂丹司琼、5HT1/2-受体拮抗剂麦特戈林或α2A肾上腺素能受体拮抗剂BRL-44408后,重复上述研究。图5f的数据显示,无论鞘内注射空载体还是阻断5-HT3受体都不能消除BLA-mPFC被抑制后产生的镇痛效应。相反,阻断5HT1/2-或α2A-肾上腺素能受体可以消除镇痛作用。如果不抑制BLA-mPFC通路以增强mPFC至vlPAG输入的条件下,上述化合物均不影响SNI小鼠的痛觉过敏。总之,这表明在神经病理性状态中,5-羟色胺能和肾上腺素能对疼痛的控制丧失。最后,鞘内注入N-(2-氯乙基)-N-乙基-2-溴苄基胺(DSP4)以去除去甲肾上腺素能下行投射,也可以消除mPFC抑制后的镇痛作用(图5f)。DSP4可以去除源自其他脑干区域的去甲肾上腺素能投射,这可能有助于下行调节。然而,去除vlPAG至LC的投射可完全消除BLA-mPFC受抑制后产生的镇痛效应,这表明mPFC抑制不参与LC以外的DSP4敏感通路。总之,本研究的数据表明,BLA通过经vlPAG途径改变mPFC对疼痛自上而下调控来调节神经病理性疼痛。
总结
本研究对BLA–mPFC–PAG–脊髓通路的功能连接组学进行了深入分析,并确定了该回路失调与疼痛的感觉和情感成分之间的因果关系。目前的数据提示了通过无创调节BLA–mPFC–vlPAG神经轴来对抗神经病理性疼痛患者的机械超敏和热痛觉过敏的可能策略。
原始文献:
Huang J, Gadotti VM, Chen L, et al. A neuronal circuit for activating descending modulation of neuropathic pain. Nat Neurosci. 2019 Oct;22(10):1659-1668. doi: 10.1038/s41593-019-0481-5. Epub 2019 Sep 9.
作 者:
刘配配
排 版:
蒋 明
校 审:
方 芳
_
缪长虹
原标题:《文献精读 | 激活神经病理性疼痛下行调控的神经环路》

