高尔基体:固有免疫调节新平台
原创 Cell Press CellPress细胞科学 来自专辑细胞出版社Trends综述

Life science
高尔基体是蛋白由内质网向其他细胞区室转运的重要枢纽,高尔基体在囊泡运输和蛋白与脂质分泌方面有重要的作用。近期的研究发现高尔基体还可以作为协调固有免疫通路的信号转导平台。
近日中国科学技术大学周荣斌教授和龚涛博士团队基于高尔基体在固有免疫信号转导中的功能,在Cell Press旗下期刊Trends in Cell Biology上发表综述,详细阐述高尔基体以其与内质网、溶酶体等细胞区室间的细胞膜网络在固有免疫应答中发挥的作用,并对未来的研究作出展望。

固有免疫应答中的高尔基体:是分选细胞器,更是信号转导平台
高尔基体是存在于真核细胞中的膜结合细胞器,由一系列单位膜构成的扁平囊叠加在一起组成。高尔基体是极化的细胞器,其扁平囊可以分为3个功能不同的部分:顺面(cis), 中间(medial)与反面(trans),在高尔基体的顺面与反面分别组成顺面高尔基网(CGN)与反面高尔基网(TGN)。来自内质网(ER)的蛋白与脂质首先由CGN接收,在高尔基体内加工后,由TGN打包并以小泡形式运送至细胞膜、胞外或溶酶体。此外,TGN也可以接收和加工来自内体的成分。作为一个由分选功能的细胞器,高尔基体在固有免疫受体、配体和产物的修饰与加工过程中享有核心地位,例如白介素6(IL-6)和干扰素β(IFN-β)等炎症因子即是由上述内质网-高尔基途径分泌的(Boncompain & Weigel, 2018; Murray & Stow, 2014)。
哺乳动物固有免疫系统通过模式识别受体(PPRs)识别细菌感染与细胞应激。至今,人们已发现5类PPRs,分别是膜结合的Toll样受体(TLRs)、C类凝集素受体(CLRs)、NOD样受体(NLRs)、视黄酸诱导基因1(RIG-I)样受体(RLRs)及一些DNA感应蛋白(Gong, Liu, Jiang, & Zhou, 2020)。活化后的PPRs不仅可以开始一系列炎症因子的分泌,而且可以诱导多种抗菌反应,如炎症细胞的死亡与自噬。以往的研究已说明PPRs介导的胞内信号通路与细胞膜、内体、内质网和线粒体等特定亚细胞结构密切相关。近期的研究发现高尔基体不仅仅是胞内分选的细胞器,其亦参与固有免疫应答的信号转导,并在其中扮演重要的角色(Brubaker, Bonham, Zanoni, & Kagan, 2015; Chen & Chen, 2018)。
高尔基体与NLRP3炎症小体
多种胞内NLRs可以启动炎症小体的组装,从而促进IL-1β与IL-18的分泌和细胞焦亡。与其他只能够被少数病原菌分子激活的炎症小体不同,NLRP3炎症小体不仅可以由病毒RNA和尼日利亚菌素(Nigericin)等分子激活,也可以由石棉和二氧化硅等环境刺激物,以及尿酸单钠晶体、胆固醇晶体和细胞外ATP等代谢产物激活。过度活化的NLRP3炎症小体能够导致多种炎症疾病,如2型糖尿病、阿尔兹海默症和脑卒中(Gong, Jiang, & Zhou, 2018; Tang, Gong, Jiang, & Zhou, 2018)。
近期研究发现,在NLRP3激动剂的作用下,溶酶体、线粒体和高尔基体等多种细胞结构发生功能失调或损伤,从而起始NLRP3炎症小体的组装。高尔基体、内质网与线粒体的连接是NLRP3炎症小体激活的重要一环(Gong, Yang, Jin, Jiang, & Zhou, 2018)。
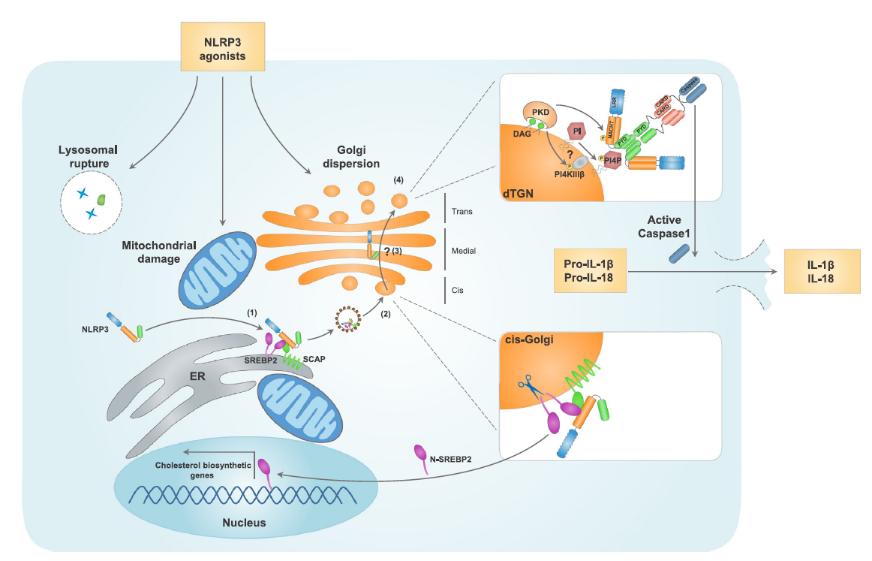
多种NLRP3激活剂诱导NLRP3与内质网上的固醇调节原件结合蛋白2(SREBP2)和SREBP切割-激活蛋白(SCAP)的相互作用。
NLRP3-SCAP-SREBP2三联复合体由内质网进入顺面高尔基体,SREBP2在这里被切割,N端SREBP2(N-SREBP2)进入细胞核并促进胆固醇合成相关基因的表达。
到达顺面高尔基体后,NLRP3也能够以动态的方式穿过高尔基体到达反面高尔基体网(TGN),经蛋白激酶D(PKD)的作用而实现磷酸化。
多种NLRP3激活剂引起TGN的分解,分解后的TGN(dTGN)则成为促进NLRP3聚集和炎症小体通过磷脂酰肌醇-4-磷酸(Ptdlns4P)组装的脚手架。除了将NLRP3磷酸化,PKD还能够通过磷脂酰肌醇-4激酶3β而激活NLRP3。
高尔基体与核酸感知
环GMP-AMP合酶(cGAS)可以直接识别胞内双链DNA,诱导第二信使环GMP-AMP(cGAMP)的产生,是固有免疫应答中重要的受体(Sun, Wu, Du, Chen, & Chen, 2013)。cGAMP与干扰素基因刺激蛋白(STING)结合并将其活化,从而激活TANK结合激酶1(TBK1)与IκB激酶(IKK),通过转录因子IFN调节分子3(IRF3)和核因子(NF)-κB,引起细胞产生I型干扰素(IFN-I)和其他炎症因子。STING最初被认为是位于内质网的跨膜蛋白,早期的研究发现活化的STING从内质网进入高尔基体并最终形成胞质小泡,与TBK1组装并促进IFN-I生成。越来越多的研究说明,内质网-高尔基体中间室(ERGIC)与高尔基体室与STING的活化息息相关(Dobbs et al., 2015)。微生物来源的双链RNA通过激活TLR3与RLR信号引起固有免疫应答。虽然这些模式识别受体的下游衔接蛋白不同,但它们都通过TBK1的招募与激活而最终导致IRF3依赖的IFN-I生成(Chow, Gale, & Loo, 2018)。
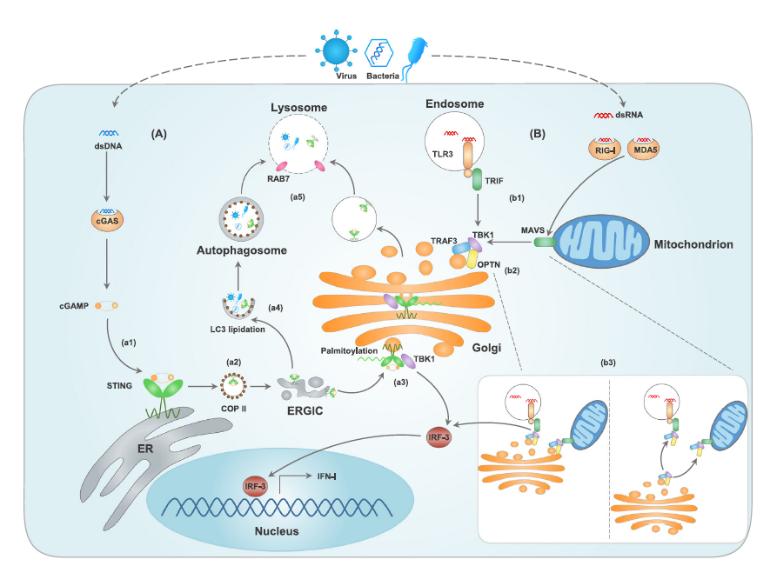
(A) cGAS直接识别胞浆内双链DNA,诱导第二信使cGAMP的产生。(a1)cGAMP与内质网上的STING结合并将其活化;(a2)与cGAMP结合后,STING以外壳蛋白复合物II(COPII)依赖的方式由ERGIC进入高尔基体;(a3)到达高尔基体后,STING被棕榈酰化,招募并激活TBK1,通过转录因子IFN调节分子3(IRF3)促进IFN-I的释放;(a4)含有STING的ERGICs也可以参与LC3脂质化和自噬小体形成;(a5)含有STING的高尔基分泌小泡和自噬小体以RAB-7依赖的方式分选进入溶酶体,引起STING和DNA降解。
(B) 微生物来源的双链RNA(dsRNA)通过TLR3、RIG-I和黑色素分化相关蛋白5(MDA5),诱导TBK1依赖的IRF3活化和IFN-I生成。(b1)活化后的内体TLR3招募衔接蛋白TRIF,胞浆RIG-I与MDA5招募并激活线粒体抗病毒信号蛋白(MAVS);(b2)衔接蛋白的激活引起TBK1的招募和转运,肿瘤坏死因子受体相关分子(TRAF3)定位于高尔基体并和OPTN-TBK1复合体相互作用,活化TBK1;(b3)高尔基体、线粒体和内体的空间排列或TBK1-OPTN复合体的动态转运对于高尔基体TRAF3-OPTN-TBK1激活而言是必不可缺的。
高尔基体与IFN诱导的GTPase
上文指出,多种PRRs的活化均促进一型干扰素(IFN-I)的生成。IFN-I通过上调多种IFN刺激基因(ISGs)发挥其抗菌、抗病毒功能,其中一类重要的蛋白为干扰素诱导的GTPase。鸟苷酸结合蛋白5(GBP5)与免疫相关GTPase家族M(ITGM)是定位于高尔基体的两类IFN-诱导的GTPase(Hansen et al., 2017; Ngo, Papa, Perera, Bolton, & Sengupta, 2017; Springer, Schramm, Taylor, & Howard, 2013)。
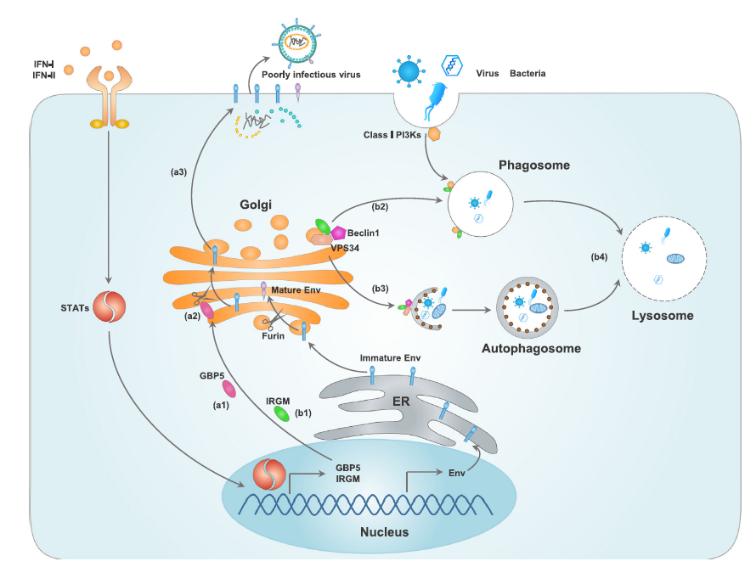
IFN-I与IFN-II均可以促进IFN-诱导GTPase的表达。(a1)GBP5和(b1)IRGM是位于高尔基体上的IFN-诱导的GTPase。(a2-a3)GBP5抑制高尔基体上的蛋白酶Furin,从而抑制病毒包膜糖蛋白(Env)的加工和结合。(b2)IRGM1由高尔基体迁移至吞噬小体,并与I类磷脂酰肌醇3激酶(PI3Ks)相互作用;(b3)IRGM促进Beclin1等自噬有关蛋白的作用;(b4)IRGM依赖的吞噬小体与自噬小体变为溶酶体,并降解胞内病原微生物。
微生物劫持策略:影响高尔基体相关固有免疫应答
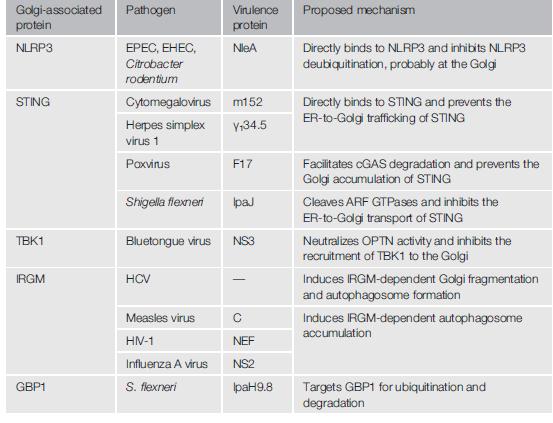
由于高尔基体在固有免疫应答中的重要作用,多种病原微生物通过靶向高尔基体或高尔基体有关蛋白的方式抑制宿主免疫反应或促进其在宿主细胞内生存。
结论与展望
教授团队对于高尔基体在固有免疫应答方面的功能进行了总结,强调了高尔基体是连接多个细胞区室的重要平台,指出其在宿主免疫应答信号转导的重要功能。而高尔基体如何与其他细胞结构相互联系,及其在固有免疫应答活化过程中的详细机制仍值得进一步研究。
本文参考文献(上下划动查看)
Boncompain, G., & Weigel, A. V. (2018). Transport and sorting in the Golgi complex: multiple mechanisms sort diverse cargo. Curr Opin Cell Biol, 50, 94-101. doi:10.1016/j.ceb.2018.03.002
Brubaker, S. W., Bonham, K. S., Zanoni, I., & Kagan, J. C. (2015). Innate immune pattern recognition: a cell biological perspective. Annu Rev Immunol, 33, 257-290. doi:10.1146/annurev-immunol-032414-112240
Chen, J., & Chen, Z. J. (2018). PtdIns4P on dispersed trans-Golgi network mediates NLRP3 inflammasome activation. Nature, 564(7734), 71-76. doi:10.1038/s41586-018-0761-3
Chow, K. T., Gale, M., Jr., & Loo, Y. M. (2018). RIG-I and Other RNA Sensors in Antiviral Immunity. Annu Rev Immunol, 36, 667-694. doi:10.1146/annurev-immunol-042617-053309
Dobbs, N., Burnaevskiy, N., Chen, D., Gonugunta, V. K., Alto, N. M., & Yan, N. (2015). STING Activation by Translocation from the ER Is Associated with Infection and Autoinflammatory Disease. Cell Host Microbe, 18(2), 157-168.
doi:10.1016/j.chom.2015.07.001
Gong, T., Jiang, W., & Zhou, R. (2018). Control of Inflammasome Activation by Phosphorylation. Trends Biochem Sci, 43(9), 685-699. doi:10.1016/j.tibs.2018.06.008
Gong, T., Liu, L., Jiang, W., & Zhou, R. (2020). DAMP-sensing receptors in sterile inflammation and inflammatory diseases. Nat Rev Immunol, 20(2), 95-112. doi:10.1038/s41577-019-0215-7
Gong, T., Yang, Y., Jin, T., Jiang, W., & Zhou, R. (2018). Orchestration of NLRP3 Inflammasome Activation by Ion Fluxes. Trends Immunol, 39(5), 393-406. doi:10.1016/j.it.2018.01.009
Hansen, M. D., Johnsen, I. B., Stiberg, K. A., Sherstova, T., Wakita, T., Richard, G. M., . . . Anthonsen, M. W. (2017). Hepatitis C virus triggers Golgi fragmentation and autophagy through the immunity-related GTPase M. Proc Natl Acad Sci U S A, 114(17), E3462-E3471. doi:10.1073/pnas.1616683114
Murray, R. Z., & Stow, J. L. (2014). Cytokine Secretion in Macrophages: SNAREs, Rabs, and Membrane Trafficking. Front Immunol, 5, 538. doi:10.3389/fimmu.2014.00538
Ngo, B., Papa, N., Perera, M., Bolton, D., & Sengupta, S. (2017). Predictors of delay to cystoscopy and adequacy of investigations in patients with haematuria. BJU Int, 119 Suppl 5, 19-25. doi:10.1111/bju.13809
Springer, H. M., Schramm, M., Taylor, G. A., & Howard, J. C. (2013). Irgm1 (LRG-47), a regulator of cell-autonomous immunity, does not localize to mycobacterial or listerial phagosomes in IFN-gamma-induced mouse cells. J Immunol, 191(4), 1765-1774. doi:10.4049/jimmunol.1300641
Sun, L., Wu, J., Du, F., Chen, X., & Chen, Z. J. (2013). Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway. Science, 339(6121), 786-791. doi:10.1126/science.1232458
Tang, T., Gong, T., Jiang, W., & Zhou, R. (2018). GPCRs in NLRP3 Inflammasome Activation, Regulation, and Therapeutics. Trends Pharmacol Sci, 39(9), 798-811. doi:10.1016/j.tips.2018.07.002


教授
周荣斌,中国科学技术大学教授,博士生导师,生命科学与医学部副部长,基础医学院执行院长。2015年获国家杰出青年科学基金支持,2016年入选科技部中青年科技创新领军人才,2017年入选中组部万人计划领军人才,2018年获基金委创新群体项目支持,2019年获科技部重点研发项目支持、入选教育部长江学者特聘教授并获国家自然科学二等奖。
主要从事免疫和炎症信号转导及疾病机制研究,以第一/通讯作者在Nature、Cell、Nat Rev Immunol、Nat Immunol、Immunity、J Exp Med等杂志发表论文20余篇,他引6000余次。获中国优秀青年科技人才奖(2016)、中国青年科技奖(2016)、谈家桢生命科学创新奖(2016)等奖项。担任Cellular & Molecular Immunology编委。任中国免疫学会青年工作委员会主任委员,基础免疫分会副主任委员。
相关论文信息
原文刊载于CellPress细胞出版社
旗下期刊Trends in Cell Biology上,

