新型冠状病毒是如何撬开免疫细胞大门的?
赵桂宪大夫
前言:近2月,我国武汉出现新型冠状病毒肺炎疫情,关于肺炎的流行病学、防护和救治,相信大家都已经关注了很多内容,我在此就不再赘述。最近有多个团队发表了新冠肺炎病理、病毒结构等相关文章,从不同水平对本病的发病机制进行了阐述,尽管到完全搞清楚疾病的本质,及特异性的治疗手段的出现还需要有个过程,但这部分内容是非常重要的。内容涉及到基因,蛋白质结构,电镜及生物信息学蛋白质构象分析等,让我想起了以前做分子生物学试验的那段日子,曾把分子生物学的试验几乎都做了一遍,想起当时和一帮师兄弟姐妹们在实验室的日子,虽然有些遥远了,但回想起来,仍然是很开心、温暖,让久违的内心激起一波涟漪,心目中一直认为把研究做到这个水平才是让人觉得过瘾和舒爽,也惭愧没有再做更多的研究。今天,我就和综合一下近期国内外学者们的研究结果和大家一起分享、学习一下,当鸡汤补补:
2020年2月11日,国际病毒分类委员会将新型冠状病毒正式命名为"SARS-CoV-2", WHO也将"新冠肺炎"疾病重新命名为冠状病毒性疾病-19(COVID-19)。"Co"代表"冠状","Vi"为"病毒。","D"为"疾病",而19代表最初的病例是在2019年出现。
SARS-CoV-2与SARS-CoV不同,但二者氨基酸水平有差异,属于不同的毒株,并非一个"新病毒"。二者均有4种主要的结构蛋白:刺突表面糖蛋白(S)、小包膜蛋白(E)、基质蛋白(M)和核衣壳蛋白(N)。SARS-COV-2的刺突表面糖蛋白中与人体血管紧张素转换酶2(ACE2)蛋白结合的5个关键氨基酸有4个发生了变化,变化后的氨基酸,在整体性上完美地维持了SARS-CoV的刺突表面糖蛋白与ACE2蛋白相互作用的原结构构象,因此,推测SARS-CoV2可能也是通过刺突表面糖蛋白与人ACE2相互作用,感染人的呼吸道上皮细胞及其他器官细胞。
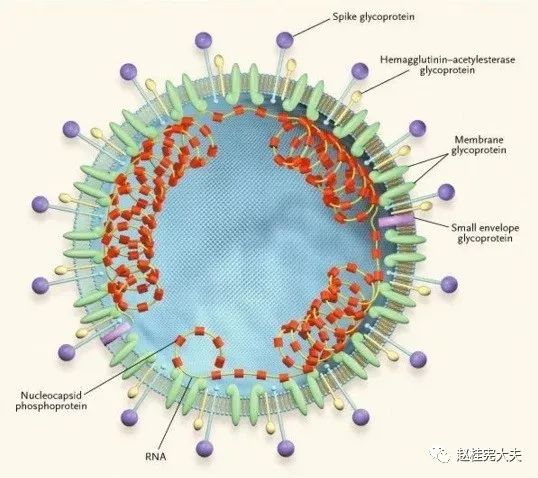
图1-1 新型冠状病毒结构示意图
对新冠病毒进行测序,发现其RNA结构域如下:

图1-2 新型冠状病毒结构域分布示意图
2月17日,解放军总医院王福生院士团队对一例新冠肺炎死亡患者进行了病理解剖。组织样本取自患者的肺、肝和心脏组织。肺组织学检查显示双侧弥漫性肺泡损伤伴纤维粘液性渗出(图2A,B)。右肺组织出现明显的肺泡上皮脱落和肺透明膜形成,提示急性呼吸窘迫综合征(ARDS;图2A)。左肺组织表现为肺水肿和肺透明膜形成,提示早期ARDS(图2B)。双肺中均可见到间质内以淋巴细胞为主的单核细胞炎性浸润。在肺泡腔中出现多核巨细胞和非典型增大的肺泡细胞,其中非典型增大的肺泡细胞具有较大的细胞核,双嗜性的细胞质内颗粒和明显的核仁,表现出病毒性细胞病变样改变(viralcytopathic-like changes)。未发现明显核内或胞浆内病毒包涵体。

图2 COVID-19患者肺、肝脏和心肌组织病理
患者的肝活检标本显示中度的微血管脂肪样变性以及轻度的肝小叶汇管区活动性炎症(图2C),提示该损伤可能由SARS-CoV-2感染或药物性肝损伤引起的。心肌间质中有少量单核细胞炎性浸润,但没有其他心肌实质损害(图2D)。
流式细胞术发现外周血CD4+和CD8+淋巴细胞数量大大减少,但它们同时也被过度激活。CD4+T细胞中具有高度促炎效应的CCR4+ CCR6+ Th17细胞增加,CD8+T细胞有高浓度的细胞毒性颗粒,其中31.6%的细胞为穿孔素阳性,64.2%细胞为颗粒溶素阳性,30.5%细胞为颗粒溶素和穿孔素双阳性。结果表明,以Th17的增加和CD8+T细胞的高细胞毒性为表现的T细胞过度活化,能够部分地解释患者的严重免疫损伤。
COVID-19多数患者发病时症状较轻,部分患者病情突然加重,关于新冠肺炎严重的肺损伤,有学者提出了"细胞因子风暴"(cytokine storm)的理论。即病毒感染机体后机体产生了过多的细胞因子,造成过度反应。细胞因子风暴实际上是一种求助信号,目的是让免疫系统瞬间快速反应,用自杀式的攻击并杀伤病毒,但也导致机体血管及器官组织和细胞损伤,血管通透性增强,渗出血液和血浆,这样的反应能够触发免疫系统对自身的猛烈攻击。细胞因子风暴还会引发一氧化氮的大量释放,这种物质会进一步稀释血液并破坏血管。所有这些因素综合起来,把血压降到了危险的水平,导致组织缺氧、低血压、多器官功能障碍和弥散性血管内凝血,因此,推测细胞因子风暴导致肺及多器官损伤及功能衰竭,可能是COVID-19患者病情突然加重和死亡的主要原因。
有了光镜水平的病理描述和分子水平的细胞因子的证据和推测,美国科学家从更微观的层面对新冠肺炎病毒做了病原学的研究。
2月11日,美国国家过敏和传染病研究所落基山实验室(NIAID-RML)研究者在扫描和透射电子显微镜上拍摄了新冠病毒(SARS-CoV-2)的图像,由视觉医学艺术办公室再对图像进行数字着色,清晰显示出新冠病毒用来入侵宿主细胞的棘突蛋白。

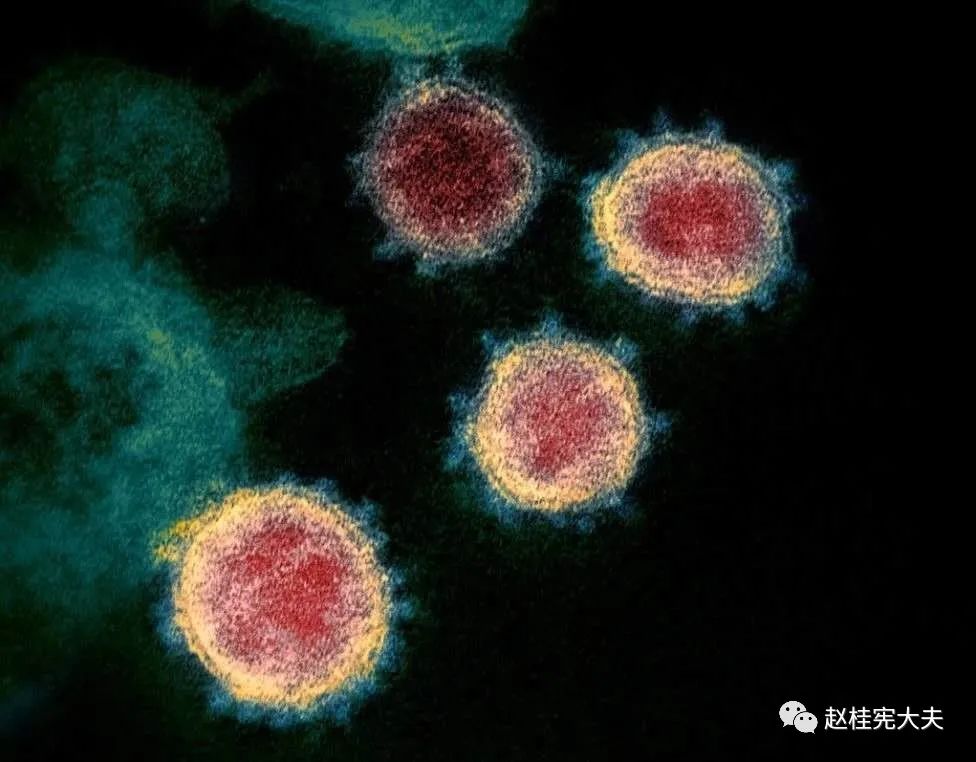
图3 新冠病毒电镜图像 病毒表面的凸起,看起来就像皇冠
以下图片中黄色的部分就是导致新冠肺炎的罪魁祸首—— 新冠病毒,多来几张,加深印象




图4 新冠病毒电镜图像经数字着色
紧接着,又有了更微观(冷冻电镜技术)水平的研究,于2月19日,美国德克萨斯大学奥斯汀分校JasonS. McLellan研究组利用冷冻电镜技术分析了新型冠状病毒表面S蛋白的近原子结构。另外作者们通过生物物理以及结构方面的证据发现,SARS-CoV-2的S蛋白结合人体ACE2(宿主细胞受体血管紧张素转化酶2)的亲和力要远高于SARS-CoV的S蛋白,解释了新型冠状病毒传染性之强的主要原因。
为了对新型冠状病毒的S蛋白预融合的结构进行解析,作者们对蛋白进行了3D结构重组,获得了3.5 Å分辨率的“向上”蛋白质结构(图5)。为了接近宿主细胞受体,S1亚基中的受体结合结构域(Receptor-binding domain,RBD)会经历铰链类似的构象移动用以隐藏或者暴露受体结合的关键位点。“向下”结构代表了受体不可结合状态,而“向上”结构则代表了受体可结合状态,“向上”结构处于较为不稳定的状态。

图5 新型冠状病毒预融合结构
通过该结构分析,作者们发现S1亚基中的RBD经历铰链类似运动,此移动特点与SARS-CoV以及MERS-CoV均非常相似,但新型冠冠状病毒中则RBD结构则更靠近三聚体的中央部位,其S蛋白中3个RBP中的1个会向上螺旋突出从而让S蛋白形成能够轻易与宿主受体ACE2结合的空间构象。这个提示新型冠状病毒的传染性更强。
将新型冠状病毒S蛋白的结构与SARS的S蛋白结构进行比较后作者们发现,两者之间结构最大的不同位于“向下”结构中的RBD结构域(图6 绿色结构区域)之中。SARS 的S蛋白中“向下”结构中RBD紧贴NTD结构域。虽然存在结构上的不同,但是整体上来说,新型冠状病毒与SARS-CoV在结构上还是高度相似的。


图6 新型冠状病毒与SARS-CoV的结构异同比较
新型冠状病毒与蝙蝠冠状病毒RaTG13在S蛋白中序列同源性高达96%,新型冠状病毒S蛋白中最显著的变化是具有S1/S2蛋白酶切割位点的“RRAR”(弗林蛋白酶识别位点)氨基酸序列,与SARS病毒中仅具有单个精氨酸不同。
除了在S1/S2连接处的氨基酸残基差异外,新型冠状病毒和RaTG13S蛋白还存在29个氨基酸残基的差异,其中17个位于受体结合的RBD部位。
新型冠状病毒结合ACE2的亲和力要远高于SARS病毒的亲和能力(>10-20倍)(图7)。这个也进一步解释了该病毒能够快速人传人的原因。

图7 新型冠状病毒病毒对于ACE2具有高亲和性
SARS病毒的RBD单克隆抗体对新型冠状病毒的RBD进行交叉反应性测试发现不具有交叉反应。
人体细胞上相应的受体蛋白好比是一把“锁”,病毒要想进入人体细胞,得有相应的“钥匙”才能打开。新冠病毒的“钥匙”是其S蛋白,而ACE2则是病毒入侵的“锁”。2月18日,西湖大学周强实验室团队利用冷冻电镜技术研究这把“锁”,他们解析了新冠肺炎病毒的受体——ACE2(血管紧张素转化酶2)的全长结构。
研究发现,ACE2-B0AT1复合物以“二聚体”形式存在,随着ACE2的肽酶结构域(PDs)转移而呈现出“开放(open)”和“关闭(closed)”两种构象。
由于作为膜蛋白的ACE2本身很难在体外稳定获得,研究团队通过共同表达的方法获得了ACE2与肠道内的一种氨基酸转运蛋白B0AT1的复合物,并利用冷冻电镜平台解析了其三维结构。
受体ACE2-B0AT1复合物:呈现开放和关闭两种构象
ACE2是一种I型膜蛋白,主要位于肺、心脏、肾脏和肠中,其表达水平与心血管疾病有关。新冠病毒感染后,人体内ACE2水平下降甚至缺失。

图8 ACE2-B0AT1 复合物的冷冻电镜密度图

图9 ACE2-B0AT1复合物的原子模型展示,糖基化部分显示为棒,复合物由亚基着色,ACE2前体中的蛋白酶结构域(PD)和Collectrin样结构域(CLD)分别为青色和蓝色
全长ACE2由一个N末端肽酶结构域(PD)和一个C末端Collectrin样结构域(CLD)组成,CLD末尾包含单个跨膜螺旋和一个有约40个残基的细胞内节段
ACE2中的PD负责裂解血管紧张素(Ang)I产生Ang-(1-9),然后被其他酶加工成为Ang-(1-7)。同时,爪状ACE2-PD的晶体结构还提供了冠状病毒S蛋白的直接结合位点。

图10 复合物“开放(open)”和“关闭(closed)”两种构象
结构比较表明,两种构象的变化仅通过PD结构域的旋转而实现,其余复合物几乎保持不变。复合物可以同时结合两个病毒S蛋白,无论是在开放还是关闭状态下,S蛋白都位于ACE2二聚体的外侧。
因此,二聚体ACE2可同时容纳两个S蛋白三聚体,可能存在二聚体ACE2和三聚体S蛋白之间的潜在聚集,这可能对膜的内陷和病毒颗粒的内吞作用很重要,这一过程类似于其他受体介导的内吞作用。
在病毒感染过程中,糖基化起着重要作用。它使病毒粒子具有高度糖基化的表面 ,帮助它们免受人体免疫细胞识别和攻击。

图11 ACE2中的糖基化位点,红色球形为在本研究中发现的
在ACE2-B0AT1复合物的结构中,一共鉴定出7个糖基化位点。这些糖基化位点中,3个位于RBD(受体结合域)结合位点附近。这些糖基化的部分是否直接参与病毒S蛋白与ACE2的结合尚待证实。
有学者推测,新型冠状病毒利用高度糖基化的同源三聚体S蛋白进入宿主细胞。S蛋白经历结构变化将病毒融合进入宿主细胞的细胞膜。此过程包括病毒的S1亚基结合到宿主细胞受体上,引发三聚体不稳定性的发生,进而造成S1亚基脱落S2亚基形成高度稳定的融合后结构。
以上这些学者们从不同研究水平(病理光镜水平、分子水平、电镜水平及冷冻电镜水平)对新冠肺炎的发病机制给予了有一定的揭示,也提出了探索,对剖析COVID-19的机制及可能促进潜在临床治疗的发展起到了重要的作用,我们也期待更多的研究。
文末,向奋战在抗疫一线的所有工作人员们致以崇高的敬意和感谢,也向奋战在实验室的研究者们致以深深的敬意,也向全国的同胞们、海外侨胞们及所有帮助我们抗击疫情的地球村的村民们表示感谢,祝大家健康、平安、幸福!
参考文献或相关文章阅读链接:
1、Identification of a new humancoronavirus.
2、Pathological findings of COVID-19associated with acute respiratory distress syndrome.
3、冠状病毒图片来源:美国卫生研究院官网
4、细胞因子风暴综合征:临床特点及治疗药物
5、有趣的动画科普:新冠肺炎是怎么传播的?
6、New Images of Novel CoronavirusSARS-CoV-2 Now Available.
7、Cryo-EM Structure of the 2019-nCoVSpike in the Prefusion Conformation.
8、Structure of dimeric full-lengthhuman ACE2 in complex with B0AT1.
8、新冠病毒侵染人体那一刻发生了什么?西湖大学深入破解

