中美科学家合作研究成果登上《科学》,或为创制新药奠定基础
一项由中美科学家团队合作研究的成果,或为创制治疗骨质疏松症等疾病的新药奠定基础。
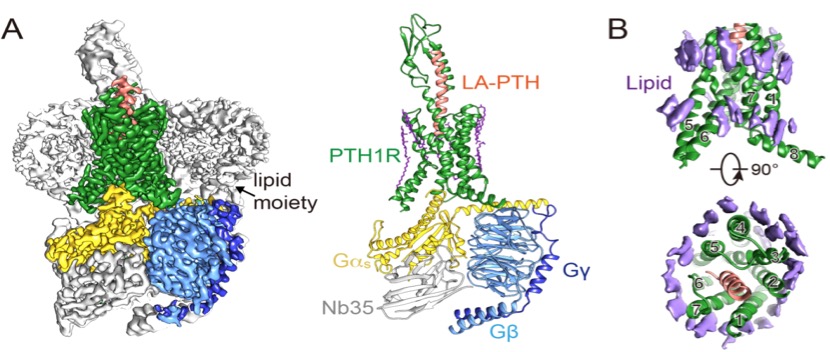
4月12日,澎湃新闻(www.thepaper.cn)记者从中国科学院上海药物研究所获悉,国际顶级学刊《科学》(Science)杂志当天以长文(Research Article;DOI: 10.1126/science.aav7942)形式发表了这项研究成果:1型人源甲状旁腺激素受体(Parathyroid hormone type 1 receptor, PTH1R)与Gs蛋白复合物冷冻电镜精准(分辨率=3.0Å)三维结构,揭示了其长效激活状态下的分子动力学机制,为创制治疗骨质疏松症、甲状旁腺功能减退症和恶病质等疾病的新药奠定了坚实的基础。
甲状旁腺激素(Parathyroid hormone, PTH)是一种典型的内分泌激素,80多年前被确定为调节血钙水平的关键因子,对维持机体离子稳态和骨骼健全至关重要。甲状旁腺激素的基因重组类似物是目前治疗严重骨质疏松症最有效的药物,但只能注射不能口服,治疗过程极其不方便而且价格昂贵,开发有效的口服药物势在必行。
科学家们先后突破了受体表达量低、蛋白稳定性差和复合物形成难等技术瓶颈,获得了长效配体LA-PTH与PTH1R及Gs蛋白结合的复合物,并解析了其三维结构。
该项研究展现了LA-PTH与胞外及跨膜结构域结合的细节,揭示了受体激活的分子机制及其与G蛋白三聚体相互作用的界面。这是首次报道的全长激活状态1型人源甲状旁腺激素受体之立体结构和首个处于长时激活状态下的GPCR三维结构,同时也阐明了持续激活时细胞内环磷酸腺苷(cAMP)信号的转导机理。
由于复合物结构的高分辨率(3.0埃),相关科学家还意外发现了许多有序排列的脂质和胆固醇分子围绕在受体跨膜区,这种现象可能具有稳定受体构象的效应。
既往的研究推测内源性配体通过“两步模式”结合并激活B类GPCR:具有强亲和力的配体羧基端首先结合受体的胞外结构域,随后配体的氨基端插入跨膜结构域的疏水口袋。然而,人们对配体如何从受体上解离知之甚少。
甲状旁腺激素既能快速激活其受体又可迅速解离。相关科研人员借助长效激动剂延长了其在受体上的停留时间,随后通过精巧细致的三维分类技术,捕捉到了配体从受体上解离的过程。
构象灵活的受体胞外结构域结合配体后仍然保留了其动态的内在特性,并在不断运动中对展现螺旋结构的配体产生两种作用:(1)靠近配体产生应力促使其解螺旋和(2)远离配体减弱其亲和力。这两种效应综合导致配体羧基端首先从受体上解离。该项研究成果增进了对B类GPCR分子识别机制的认识。
该成果是由中国科学院上海药物研究所徐华强团队和王明伟团队、浙江大学基础医学院张岩团队以及美国匹兹堡大学医学院Jean-Pierre Vilardaga团队合作研究的。徐华强课题组赵丽华副研究员和博士研究生马山山、浙江大学沈丹丹博士和美国匹兹堡大学Ieva Sutkeviciute博士为该论文的共同第一作者。
参加这项研究的合作单位还有美国文安德研究所(Van Andel Research Institute)、复旦大学和美国哈佛医学院,经费来自中国科学院、国家自然科学基金委员会、国家科学技术部、国家卫生健康委员会、美国国立卫生研究院、上海市科学技术委员会、复旦大学‒中国科学院上海药物研究所融合创新基金、诺和诺德‒中国科学院研究基金和中美两国多个人才资助专项(如中国科学院青年创新促进会)等。
