临床研究十大亮点 | 盘点2024全球垂体腺瘤领域新突破④
原创 吴哲褒医疗团队 垂体探秘
让我们跟随吴哲褒教授的视角,继续回顾2024年度在垂体腺瘤领域的重大研究成果。今天,我们将从亮点临床研究方面进行分析,对2024全球垂体腺瘤领域新突破进行盘点,欢迎广大垂体瘤领域临床和科研工作者批评指正。
2024年垂体瘤领域亮点临床研究主要聚焦在垂体瘤外科手术、ACTH腺瘤及多学科交叉例如分子影像学在垂体瘤,AI在垂体瘤的术中识别,我们选择了以下10篇亮点临床研究。
立体定向外科治疗

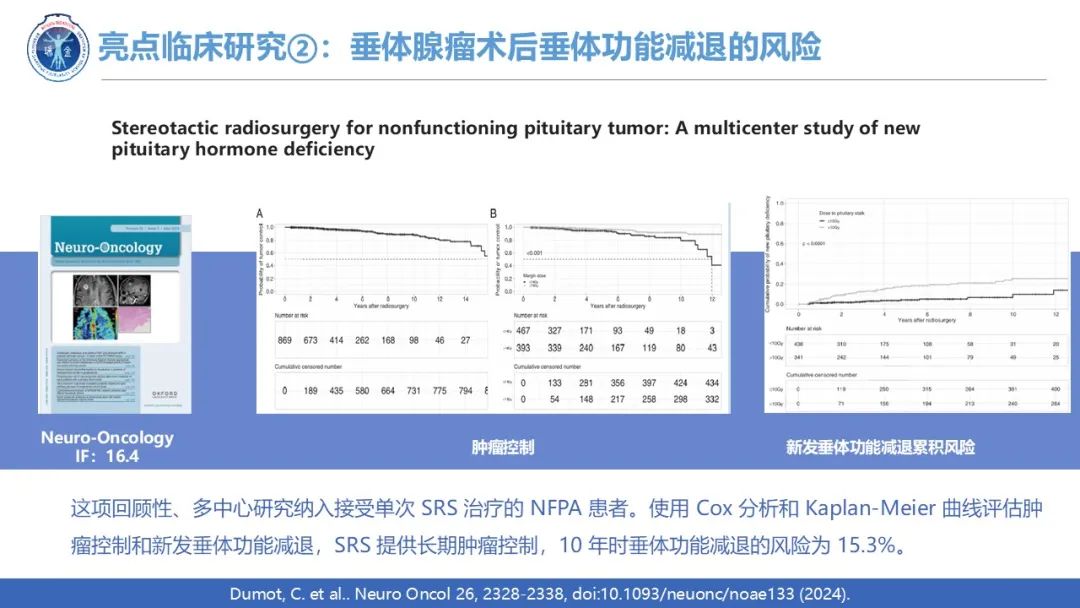
对于垂体瘤的治疗,放疗发挥重要作用,但常规放疗往往伴随着并发症的发生,影响着临床上的决策。立体定向放射外科 (SRS) 是一种更有针对性的方法,现在越来越多地被临床应用。例如来自美国弗吉尼亚大学神经外科Jason P Sheehan教授连续于2024年4月、12月在国际知名期刊Neuro-Oncology发表两项关于SRS临床研究,旨在评估SRS对垂体瘤的新发并发症发生率。与常规放疗对照组相比,SRS 组在影像学监测下未见长期继发性脑肿瘤(p=0.6),新发颈动脉狭窄或闭塞(p=0.8)和中风的风险增加(p=0.26)。此外, SRS 提供长期肿瘤控制且术后10 年垂体功能减退的风险为 15.3%。

临床侵袭标记

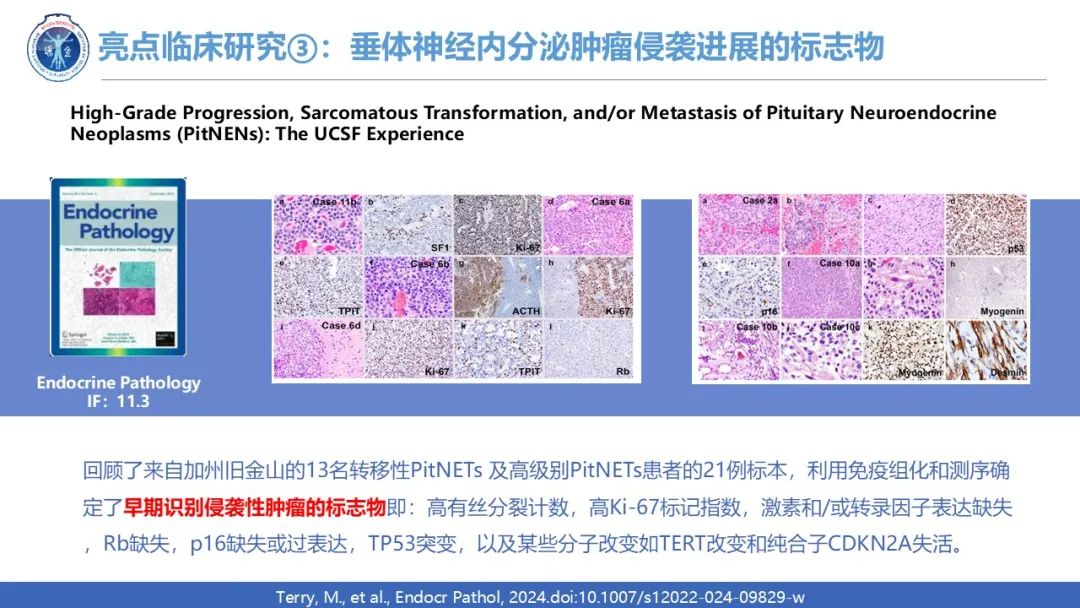
临床上,侵袭性垂体内分泌肿瘤有着一些很典型的分子改变:来自美国加州大学旧金山分校神经外科的13名转移性PitNETs 及高级别PitNETs患者的21例标本的免疫组化和测序确定了早期识别侵袭性肿瘤的标志物即:高有丝分裂计数,高Ki-67标记指数,激素和/或转录因子表达缺失,Rb缺失,p16缺失或过表达,TP53突变,以及某些分子改变如TERT改变和纯合子CDKN2A失活,该成果2024年12月发表期刊国际期刊Endocrine Pathology上。
基于研究结果,不建议NFPA患者常规使用SSAs。尽管该研究得到的阴性结果,但为临床决策NFPA的治疗选择提供了广阔思路例如外科干预。
药物治疗

药物治疗的范围在不断扩大,并延申至无功能腺瘤并已进行相应的临床实验。非功能性垂体大腺瘤(NFPMA)的患者目前缺乏确立的药物治疗选择。研究表明,生长抑素类似物(SSA)可能有助于抑制肿瘤生长,但尚无随机对照试验的证据支持。2024年2月发表在Lancet Reg Health Eur的来自荷兰三家医院一项多中心、随机、双盲、安慰剂对照的 III 期临床试验,它旨在评估兰瑞肽(一种长效生长抑素类似物)对 68Ga-DOTATATE PET 阳性 NFPMA 患者肿瘤大小的影响。纳入患有 44例Ga-DOTATATE PET 阳性 NFPMA 的成年患者(直径 ≥10 mm 的术后残留或未经手术的垂体大腺瘤)。将 44 名 PET 阳性的患者随机分配至兰瑞肽或安慰剂组,治疗结束时,兰瑞肽组与安慰剂组之间的肿瘤最大直径变化无显著差异(95%CI−1.3 to1.2, p=0.93)。两组在肿瘤体积、肿瘤进展时间以及生活质量评分的变化上均未见显著差异。兰瑞肽组较安慰剂组不良事件发生率较高(100% vs. 95%),其中胃肠道相关不良事件最常见。

外科治疗

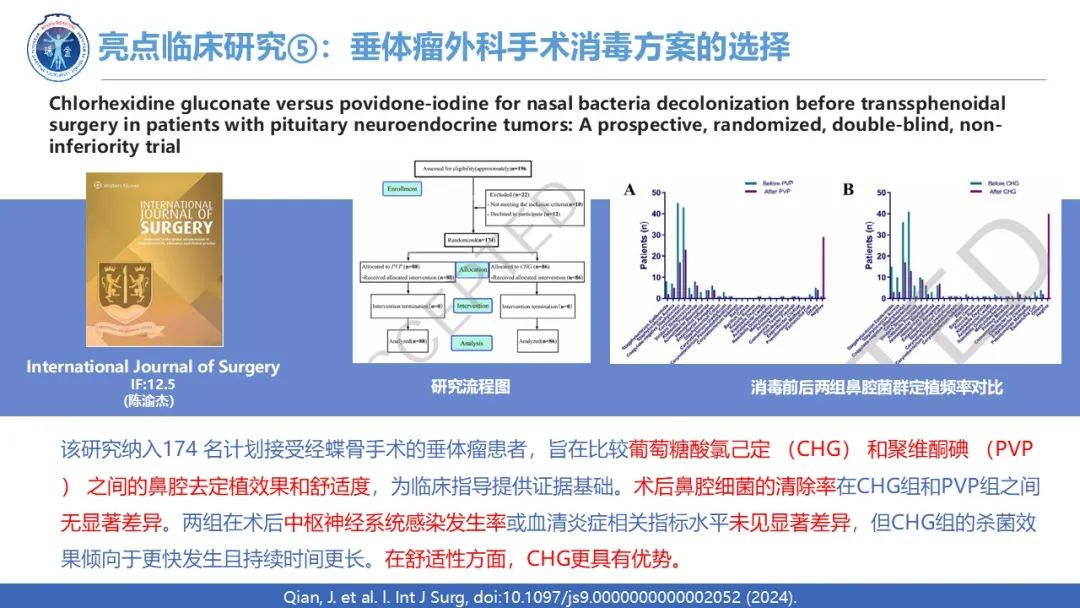
外科手术,工欲善其事必先利其器,外科消毒是一台完美外科手术的重要组成部分,旨在避免感染等并发症。来自陆军军医大学西南医院神经外科陈渝杰教授2024年8月在International Journal of Surgery发表了一项有关消毒剂在垂体瘤手术应用的前瞻性、随机、单盲临床试验,旨在比较葡萄糖酸氯己定 (CHG) 和聚维酮碘 (PVP) 之间的鼻腔去定植效果和舒适度,为临床指导提供证据基础。该研究纳入174 名计划接受经蝶骨手术的垂体神经内分泌肿瘤患者,术后鼻腔细菌的清除率在CHG组和PVP组之间无显著差异(88.64% vs. 82.56%; 95%CI: [-5.30, 17.50])。两组在术后中枢神经系统感染发生率或血清炎症相关指标水平未见显著差异,但CHG组的杀菌效果倾向于更快发生且持续时间更长。在舒适性方面,CHG似乎具有优势,包括较少的鼻腔刺激感、较低的刺激性气味以及更好的鼻腔着色效果。
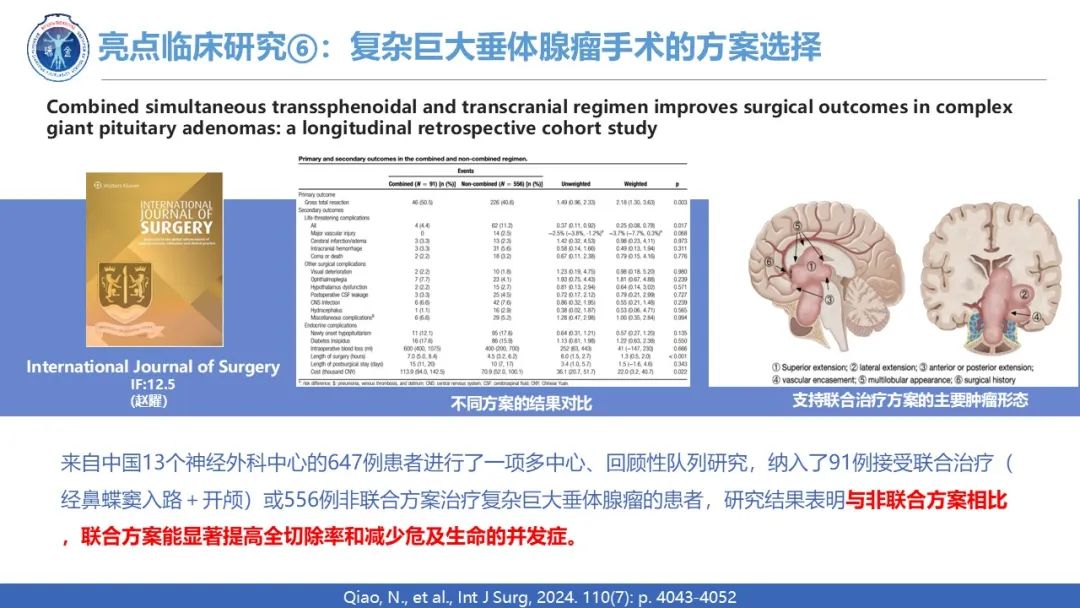
外科手术依旧是垂体瘤临床的一大重要板块,2024年7月由复旦大学附属华山医院神经外科赵曜教授牵头,联合来自中国的 13 个神经外科中心进行了一项回顾性、多中心研究,该研究发表在国际外科学杂志在International Journal of Surgery,旨在评估经蝶骨和经颅入路联合治疗巨大复杂垂体腺瘤(GPA)的有效性和安全性。纳入 647 名患有复杂 GPA 的患者 91 名在联合组中,556 名在非联合组。与非联合方案相比,联合治疗与较高的大体全切除概率相关 (50.5% vs. 40.6%, OR:2.18,95% CI:1.30-3.63,P = 0.003)。 联合组发生危及生命的并发症的患者比例低于非联合组 (4.4% vs. 11.2%,OR: 0.25,95% CI: 0.08–0.78,P = 0.017)。 在其他手术或内分泌相关并发症方面,两组之间未发现显著差异。然而,与非联合方法相比,联合方案的平均手术持续时间更长(P < 0.001)及手术费用更高(P = 0.022)。
ACTH腺瘤

ACTH腺瘤由于其高异质性越来越在临床诊疗受到关注,肿瘤颗粒密度模式是影响垂体瘤生物学行为的重要因素,被列入WHO2022垂体瘤指南共识中,并逐渐得到临床的一致认可。来自土耳其的一项有关垂体瘤颗粒密度研究2024年9月在Endocrine Pathology发表,该研究回顾了41例功能性ACTH腺瘤特征, 28例致密颗粒型ACTH肿瘤(DGCT)和13例稀疏颗粒型ACTH肿瘤(SGCT)。与DGCT相比, SGCT组的肿瘤更大(p = 0.049),有丝分裂计数更高(p = 0.001),T2强度与白质之比更高(p=0.049)。在多变量分析中,SGCT仍然是早期生化缓解概率较低的独立预测因子(p = 0.012)。这提示临床医生对临床上稀疏颗粒型ACTH腺瘤治疗及随访的重视。

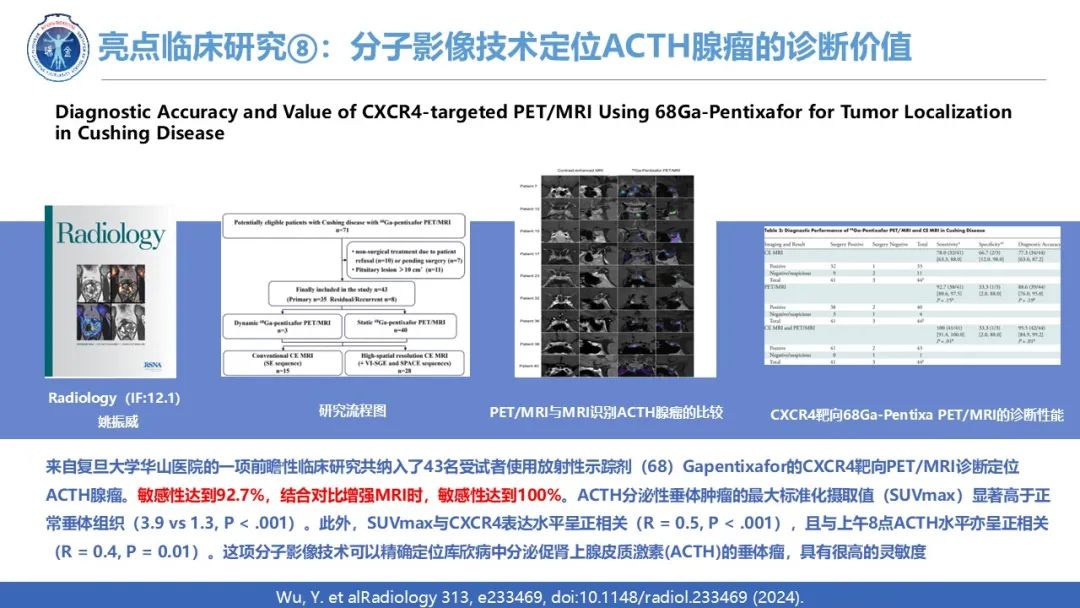
ACTH腺瘤具有小腺瘤大功能分泌的特点,很大一部分微腺瘤在MRI上无法检测到,此外异常MRI信号不一定提示功能性腺瘤,可能导致神经外科手术中的误解。复旦大学神经外科研究所张麒麟教授联合华山医院放射科姚振威教授,于2024年12月在影像学顶刊Radiology顶刊发表原创性前瞻性临床研究,指出使用放射性示踪剂(68)Gapentixafor的C-X-C趋化因子受体4型(CXCR4)靶向PET/MRI的诊断准确性和价值。这项技术可以精确定位库欣病中分泌促肾上腺皮质激素(ACTH)的垂体瘤,具有很高的灵敏度。引入了镓68标记的Pentixafor PET/MRI用于库欣病患者肿瘤定位的研究,共纳入了43名受试者。仅使用(68)Ga-Pentixafor PET/MRI定位41例分泌性ACTH腺瘤时,敏感性达到92.7%;结合对比增强MRI时,敏感性达到100%(41例肿瘤全部准确定位)。ACTH分泌性垂体肿瘤的最大标准化摄取值(SUVmax)显著高于正常垂体组织(3.9 vs 1.3, P < .001)。此外,SUVmax与CXCR4表达水平呈正相关(R = 0.5, P < .001),且与上午8点ACTH水平亦呈正相关(R = 0.4, P = 0.01)。
临床上,库欣病(CD)患者生化缓解后会伴随着自身免疫系统疾病的发生,2024年3月来自美国哈佛医学院发表在Annals of Internal Medicine的一项包括286例ACTH腺瘤患者的回顾性队列研究确定了手术缓解 CD 的患者比年龄和性别匹配的 NFPA 患者发生自身免疫性疾病的几率更高,并得出来自身免疫性疾病家族史是潜在的危险因素及肾上腺皮质功能减退症是诱因的结论。具体来说:CD 患者术后 3 年新发自身免疫性疾病的累积发生率 (10.4% ,95% CI [5.7%,15.1%])高于NFPA 患者(1.6%, 95%CI, [0% ,4.6%]) (HR:7.80, 95%CI,[2.88,21.10])。与 NFPA 患者相比,CD 患者术后肾上腺皮质功能减退症的患病率更高 (93.8% vs. 16.5%) 和更低的术后最低血清皮质醇水平 (63.8 vs. 282.3 nmol/L)。与无自身免疫性疾病的 CD 患者相比,发生自身免疫性疾病的患者术前 24 小时 UFC 比值较低 (2.7 vs. 6.3)和自身免疫性疾病家族史患病率较高 (41.2% vs. 20.9%)。

AI应用

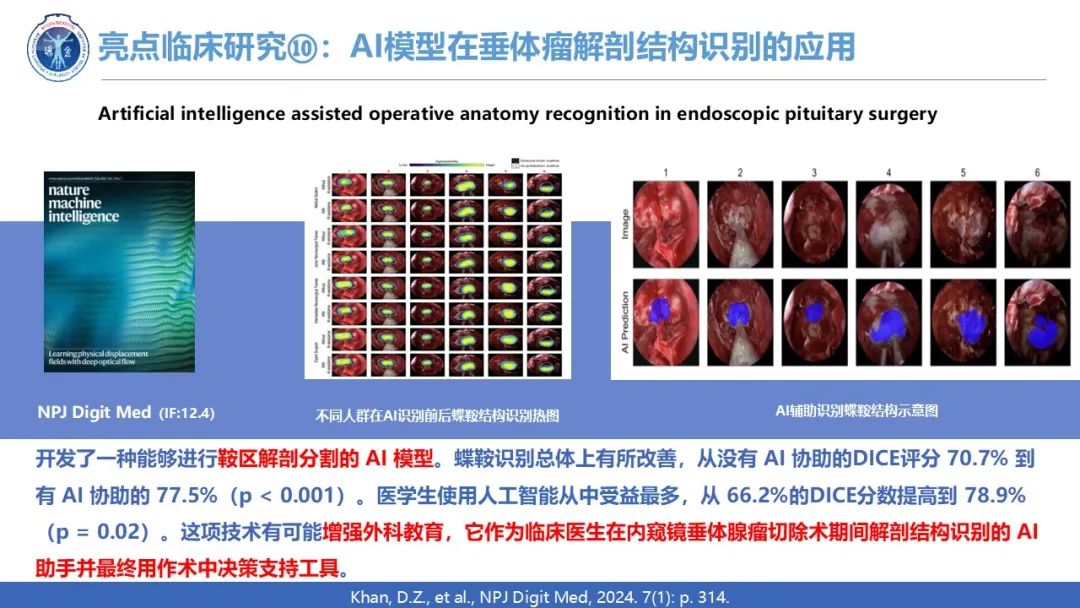
人工智能是近几年的热点,互联网+垂体瘤也在2024年垂体瘤领域碰撞出了火花,一篇有关AI模型在垂体瘤应用的文章2024年11月发表在数字医学期刊NPJ Digit Med。垂体体瘤被关键的神经血管结构包围,术中识别这些结构可能具有挑战性。该团队之前开发了一种能够进行鞍区解剖分割的 AI 模型。蝶鞍识别总体上有所改善,从没有 AI 协助的DICE评分 70.7% 到有 AI 协助的 77.5%(p < 0.001)。医学生使用人工智能从中受益最多,从 66.2%的DICE分数提高到 78.9% (p = 0.02)。这项技术有可能增强外科教育,它作为临床医生在内窥镜垂体腺瘤切除术期间解剖结构识别的 AI 助手并最终用作术中决策支持工具。
完
至此,由上海交通大学医学院附属瑞金医院神经外科吴哲褒教授团队原创的《盘点2024全球垂体腺瘤领域新突破》系列已推送完毕,谢谢关注!
THE END
结 语
回顾2024,是突破与进取并肩的岁月,全球复苏的春风吹拂,唤醒了垂体瘤领域每一处潜藏的希望与力量。从全球协作到创新竞逐,学术的智慧在交锋中碰撞,临床的实践在探索中深耕,为垂体瘤的治疗与研究夯实了基础。
站在2025年的起点,2024的每一份成就都将成为新的起跑线。让我们继承前人的智慧火种,胸怀远大志向,借创新为桨,向着垂体瘤领域的浩瀚未知勇敢破浪,迎接更加辉煌的明天!

