CRMed:范存义与郑颂国团队联手揭示周围神经再生障碍的机制和干预策略
原创 Cell Press CellPress细胞科学
 医学
医学Medicine
2024年10月18日,上海市第六人民医院国家骨科医学中心范存义教授团队与上海交通大学医学院细胞和基因治疗研究院郑颂国教授课题组合作,在Cell Press细胞出版社期刊Cell Reports Medicine发表论文,题为“Schwann cell-secreted frizzled-related protein 1 dictates neuroinflammation and peripheral nerve degeneration after neurotrauma”。施旺细胞(Schwann cell)对于周围神经再生至关重要,该研究首次发现损伤状态下的施旺细胞可分泌secreted frizzled-related protein 1 (sFRP1) 加剧神经组织局部炎症,阻碍神经修复过程。这一结果在小鼠周围神经损伤(peripheral nerve injuries, PNIs)模型和创伤患者截肢神经样本中均得到证实,是施旺细胞的一种非典型功能,为开发有效治疗靶点提供新思路。
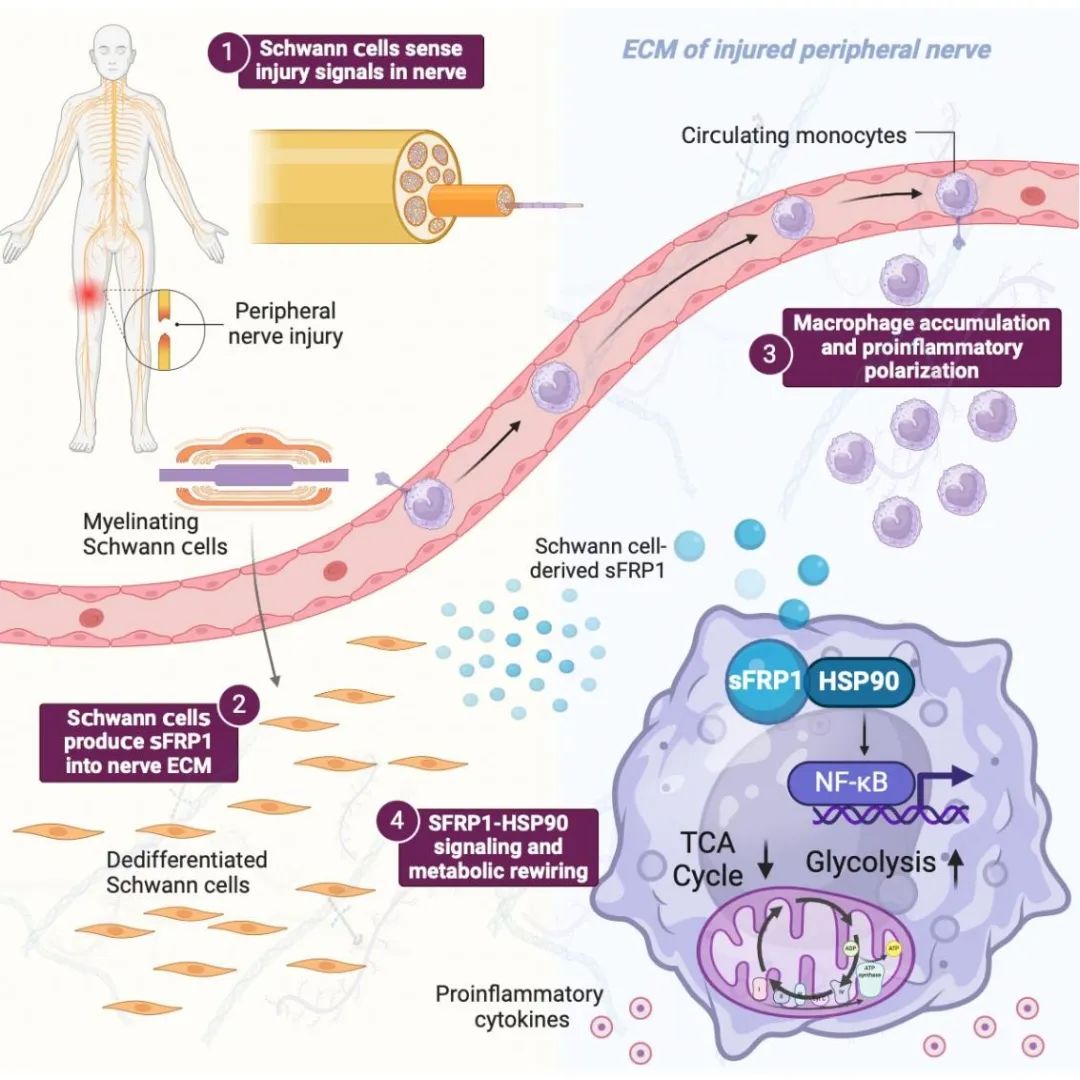
随着交通运输与建筑业的发展,周围神经损伤(peripheral nerve injury, PNI)占我国外伤人群5%以上,表现为靶器官感觉与运动功能失调,全球范围内相关医疗支出超过1000亿美元。当前临床治疗PNI效果有限,总体功能恢复率不足40%,严重影响患者的生产与生活,甚至导致终生残疾,加重了家庭与社会负担。PNI早期表现为局部炎症反应,损伤神经通过释放趋化因子募集大量单核/巨噬细胞等固有免疫细胞,损伤的髓鞘碎片与轴突被吞噬降解。在修复期,微环境中炎症水平降低,血管内皮细胞和增殖型施旺细胞等归巢至损伤部位,形成血管与新生髓鞘(即Büngner带),诱导轴突修复。因此,适量的炎症可辅助推进神经再生进程;然而,创伤或医源性因素导致的PNI常产生过量且长期的炎症,导致髓鞘难以形成,轴突持续降解,神经及其靶器官再生障碍。基于炎症调控策略,探索PNI潜在分子治疗靶点意义重大。周围神经中的施旺细胞对轴突的支持和髓鞘形成至关重要,确保了中枢神经系统和外周之间的快速和准确的交流。在损伤状态下,施旺细胞具有非凡的可塑性和强大的病理调节能力,能够去分化为修复型状态,分泌神经营养因子,促进受损的神经元的存活及其轴突的再生。
本研究利用多组学分析发现PNI患者和小鼠损伤神经中的施旺细胞高表达分泌型卷曲相关蛋白(secreted frizzled-related protein 1, sFRP1),而在正常神经中sFRP1的表达水平较低。为了探究施旺细胞来源的sFRP1对周围神经再生的影响,研究人员构建了Sfrp1flox/floxPlpcre-Ert1小鼠,通过坐骨神经离断模型证实施旺细胞来源的sFRP1可募集巨噬细胞并将其诱导为炎症表型,明显改变损伤神经炎症水平与组织再生质量。基于此,研究人员进一步探究了sFRP1与巨噬细胞的联系,通过免疫共沉淀联合质谱明确sFRP1与巨噬细胞热休克蛋白(heat shock protein 90, HSP90)结合,从而发挥作用。据此提出假说:损伤神经施旺细胞分泌sFRP1,与巨噬细胞HSP90形成复合体激活炎症级联反应,破坏神经及其靶器官再生。随后研究人员构建了Hsp90flox/floxLyz2cre小鼠坐骨神经损伤模型,探究巨噬细胞特异性HSP90清除是否会对sFRP1信号的作用效果产生影响。实验结果证实了HSP90通过调控巨噬细胞表型,从而介导sFRP1诱导的神经炎症反应。综上所述,本研究验证了sFRP1-HSP90信号轴在炎症调控、神经修复与靶器官再生中的作用机制,为开发有效治疗靶点提供依据。
 作者专访
作者专访Cell Press细胞出版社特别邀请本文通讯作者范存义教授进行了专访,请他为大家进一步解读。
CellPress:
本研究对指导周围神经修复有哪些具体意义?
范存义教授:
周围神经损伤发病率高且预后欠佳,易导致肢体残疾。目前,显微手术修复是临床治疗的主要方法,但效果欠佳。究其原因,周围神经修复缺乏精准有效的治疗手段。再生神经结构和功能的维持依赖于稳定的免疫微环境。损伤的周围神经组织中有大量固有免疫细胞的浸润,如巨噬细胞和中性粒细胞。促炎免疫细胞的过度浸润及分泌大量炎症因子,是导致神经组织结构持续破坏和轴突再生迟缓的关键因素。因此,深入研究免疫微环境紊乱和神经-免疫交互机制,阐明介导神经炎性损伤的关键分子,对寻找针对性干预措施意义重大。
CellPress:
本项研究有哪些创新点和亮点呢?
范存义教授:
在既往研究中,损伤神经中的施旺细胞介导轴突再生和髓鞘化,是推动周围神经再生的主要驱动力。本研究利用多组学联合分析发现,损伤神经中的施旺细胞具有间充质细胞特征,通过分泌sFRP1诱发周围神经持续性炎症,抑制周围神经再生。随后本研究利用施旺细胞特异性sFRP1缺失小鼠Sfrp1flox/floxPlpcre-Ert1小鼠验证了sFRP1可造成轴突再生障碍,并在动物体内和类器官体外模型上进一步证实了靶向sFRP1的中和抗体提高治疗效率的可行性。PNI中神经炎症的调控机制复杂,本项目聚焦功能最活跃的巨噬细胞,利用免疫共沉淀联合质谱分析明确巨噬细胞中,识别sFRP1的关键分子HSP90,进一步构建巨噬细胞特异性HSP90缺失小鼠Hsp90flox/floxLyz2cre,证实了施旺细胞和巨噬细胞的互作机制及其作用,相比同类研究逻辑更完整、证据更充分。总之,我们的研究通过体、内外实验证实sFRP1-HSP90信号轴在神经修复中的作用效果,该信号轴有潜力作为PNI新型靶向治疗方案,临床转化前景广阔。
CellPress:
您认为目前的周围神经再生转化研究主要瓶颈在哪里?
范存义教授:
现阶段,周围神经再生转化研究的难点在于缺少合适的临床前动物模型和人源性类器官模型。虽然我们团队长期以来建立了多个PNI模型,在周围神经修复研究中开发了多个有价值的治疗靶点,但仅仅通过特异性抑制剂或基因敲除等干预方法无法真正用于患者,因此亟需开发更能代表人体生理状态的大动物模型,开发PNI新型靶向治疗方案,将基础研究成果转化为行之有效的治疗方法,以真正造福患者。
 作者介绍
作者介绍 范存义
范存义教授
范存义,医学博士,上海交通大学二级教授、博士生导师,国家骨科医学中心副主任、市六医院骨科行政主任,国家重点研发计划首席科学家、上海市领军人才和优秀学科带头人。享受国务院特殊津贴,获上海工匠、银蛇奖特别荣誉奖、上海医务工匠、上海市劳模创新工作室等荣誉。擅长肘关节功能障碍、复杂骨缺损和肢体复杂组织损伤的诊疗。以第一完成人获国家科技进步二等奖、上海市技术发明一等奖、上海市科技进步一等奖和广慈转化医学创新奖等奖项。主持科技部重点研发计划、国自然重点项目(2项)等课题,组建2个省部级研发与转化平台,发表SCI论文260篇,H指数42,总IF 1554分,成果纳入国际标准和指南9项、国际教科书和专著82部。培养博士后8人、博士56人、硕士26人,国自然杰青1人、优青1人、海外优青1人。
其他作者:
本文的第一作者是上海市第六人民医院骨科姚湘云博士,共同作者包括上海市第六人民医院骨科孔令驰博士和乔义博士。上海市第六人民医院骨科钱运副研究员和上海交通大学医学院细胞和基因治疗研究院郑颂国教授为该论文的共同通讯作者。该项工作得到英国帝国理工学院的Simone Di Giovanni教授的大力支持。
原标题:《CRMed:范存义与郑颂国团队联手揭示周围神经再生障碍的机制和干预策略 | Cell Press对话科学家》

