Nature子刊:北京大学张莹团队等揭示早期肿瘤编辑机制及其在肿瘤免疫治疗中的潜在应用
编辑丨王多鱼
排版丨水成文
免疫治疗已彻底改变了癌症治疗的前景并治愈了一部分难以治疗的癌症。然而,大多低免疫原性肿瘤仍对现有免疫疗法响应率极低。揭示肿瘤免疫逃逸机制有助于高效识别免疫治疗新靶点,扩大可治疗肿瘤的范围。早期肿瘤形成中,肿瘤会编辑其基因表达以逃避免疫监视,该“肿瘤编辑”过程是塑造肿瘤免疫原性的关键时期。新生肿瘤中优先沉默的基因很可能对提升肿瘤免疫原性及诱发有效的抗肿瘤免疫反应起重要作用。
探究早期肿瘤编辑优先下调的基因及其表达调控机制将为找到更具抗癌潜力的免疫治疗靶点提供重要指南。然而,肿瘤在被临床检测到前已经历了广泛的编辑,捕获肿瘤编辑早期事件在技术上颇具挑战性。常用的同源移植肿瘤模型中,肿瘤细胞系已在体内被充分编辑过,很难用于早期肿瘤编辑相关研究。由于检测及分离早期肿瘤的难度,新发肿瘤中的基因编辑程序及其作用机制尚不明确。肿瘤编辑的前期研究中,关注点通常局限于活化适应性免疫所需关键基因,如抗原呈递与加工相关基因等的表达调控。其他可能在肿瘤发生初期调控其免疫原性的重要途径, 特别是先天免疫途径的活性变化仍然未知。
直到最近,尚未有研究在全基因组范围内分析早期肿瘤编辑过程,并以单细胞分辨率解析该过程中肿瘤细胞及肿瘤浸润淋巴细胞(Tumor-infiltrating lymphocytes,TIL)内的基因表达动态变化。
2024年8月21日,北京大学生命科学学院、北大-清华生命科学联合中心张莹课题组与哈佛大学医学院合作,在 Nature Immunology 期刊发表了题为:Tumor editing suppresses innate and adaptive anti-tumor immunity and is reversed by inhibiting DNA methylation 的研究论文。
该研究利用可诱导乳腺癌的转基因小鼠模型收集极早期及晚期肿瘤进行全面的单细胞转录组测序(scRNA-seq),揭示了早期肿瘤编辑对肿瘤中关键先天及适应性免疫通路的优先沉默,对TIL分化、功能及肿瘤-免疫细胞通信的显著影响,并阐释了DNA去甲基化治疗在逆转肿瘤免疫编辑、促进炎性癌细胞死亡、提升肿瘤免疫原性及抗肿瘤免疫力方面发挥的重要功效。

转基因小鼠肿瘤模型中,诱导特定组织内致癌基因的表达可在原位引发肿瘤,肿瘤细胞可特异性表达荧光蛋白以便于早期肿瘤的捕获。相较于依赖细胞系的移植肿瘤,转基因小鼠肿瘤更接近人类癌症,通常对免疫治疗不敏感,是研究早期肿瘤编辑、肿瘤微环境中肿瘤-免疫互作演变及潜在免疫治疗策略的理想严格模型。
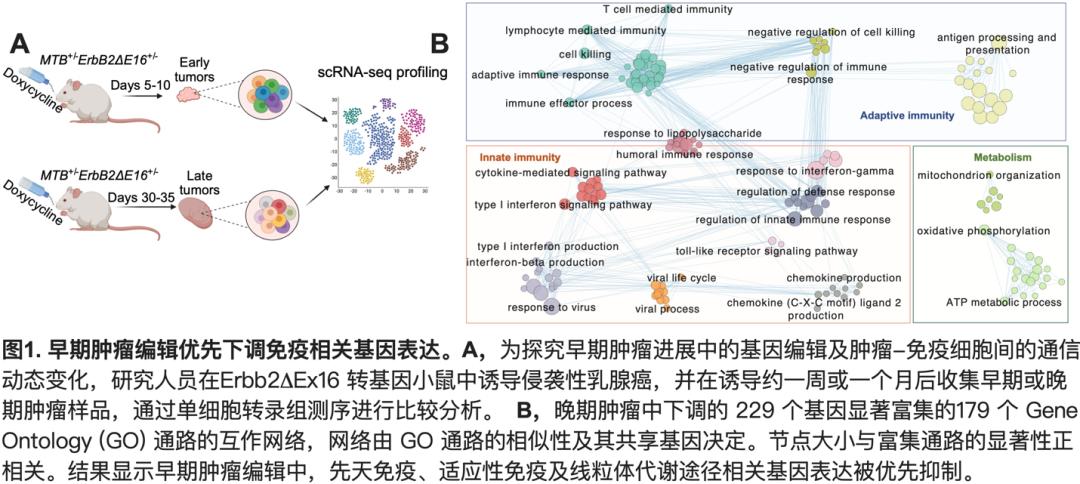
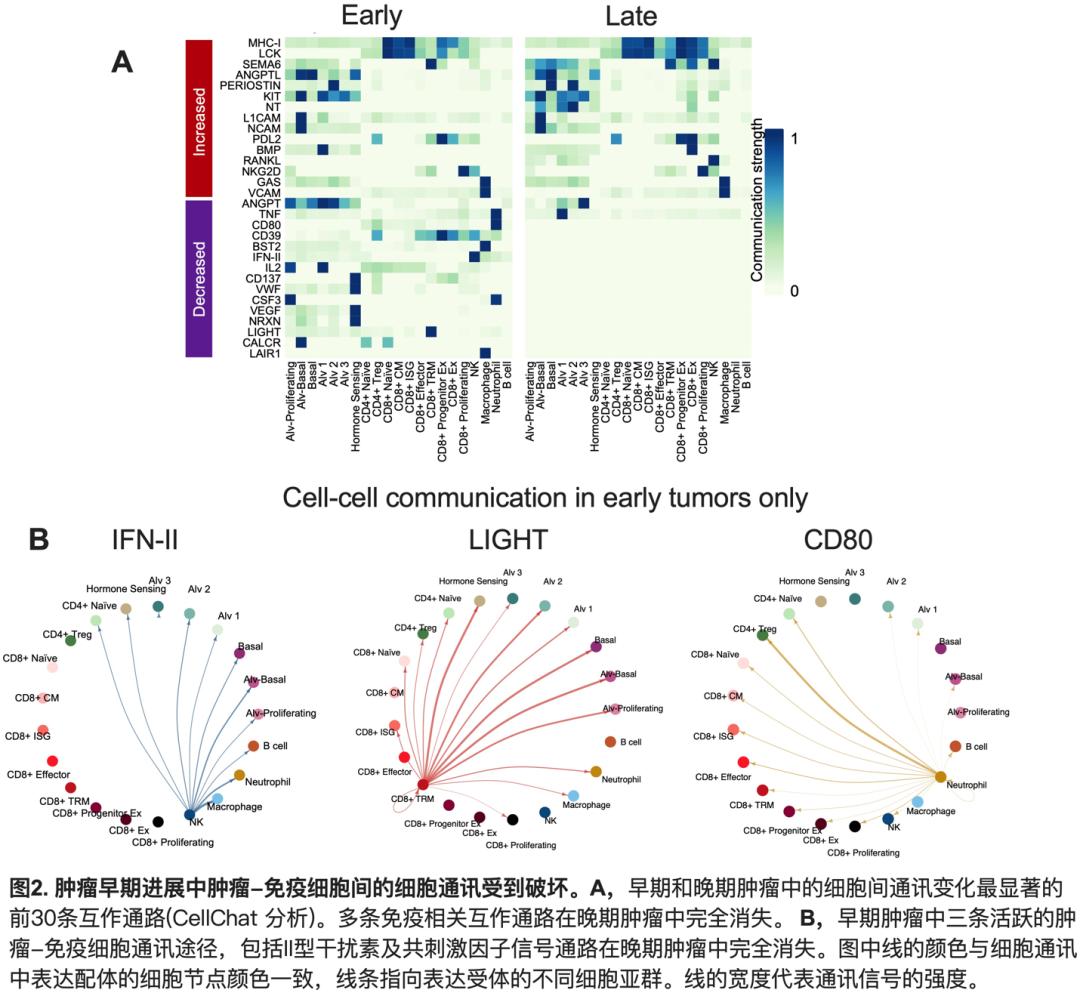
在这项研究中, 研究团队利用了一种可诱导乳腺癌的转基因小鼠模型——ErbB2Ex16小鼠,其可在多西环素(Dox)诱导后在乳腺上皮细胞中特异表达致癌基因Her2的持续激活突变体ErbB2Ex16,在7-28天内引发侵袭性乳腺癌。乳腺肿瘤的浅表位置使研究者可第一时间探测肿瘤发生并取样。Dox诱导仅一周左右, 研究者即可收集新发早期肿瘤, 并收集诱导一个月左右的晚期肿瘤同时进行scRNA-seq, 分析肿瘤早期发生过程中肿瘤细胞和TIL内全基因组水平的基因表达变化 (图1.A)。结果显示,晚期肿瘤相较于早期肿瘤主要下调先天及适应性免疫途径相关基因的表达 (图1.B),而与肿瘤细胞自身存活、增殖及侵袭相关基因的表达变化不大,提示早期肿瘤编辑主要为免疫编辑。下调基因主要富集在先天免疫途径,包括I型及II型干扰素(IFN)信号传导, 病毒防御反应, 及细胞因子信号通路。晚期肿瘤细胞中下调基因所富集的前20条最显著通路全部为先天免疫途径, 提示其对肿瘤免疫原性有重要影响。肿瘤进展中,早期肿瘤中初始及效应CD8+ TIL大部分被功能耗竭或耗竭前体CD8+ TIL所取代。同时, 肿瘤细胞与NK或不同CD8+ TIL亚群之间的多种重要通讯,包括IFN-γ及IL-2通路,CD80和LIGHT共刺激信号等抗肿瘤免疫途径均被破坏(图2),突显了早期肿瘤编辑削弱肿瘤免疫原性的能力。
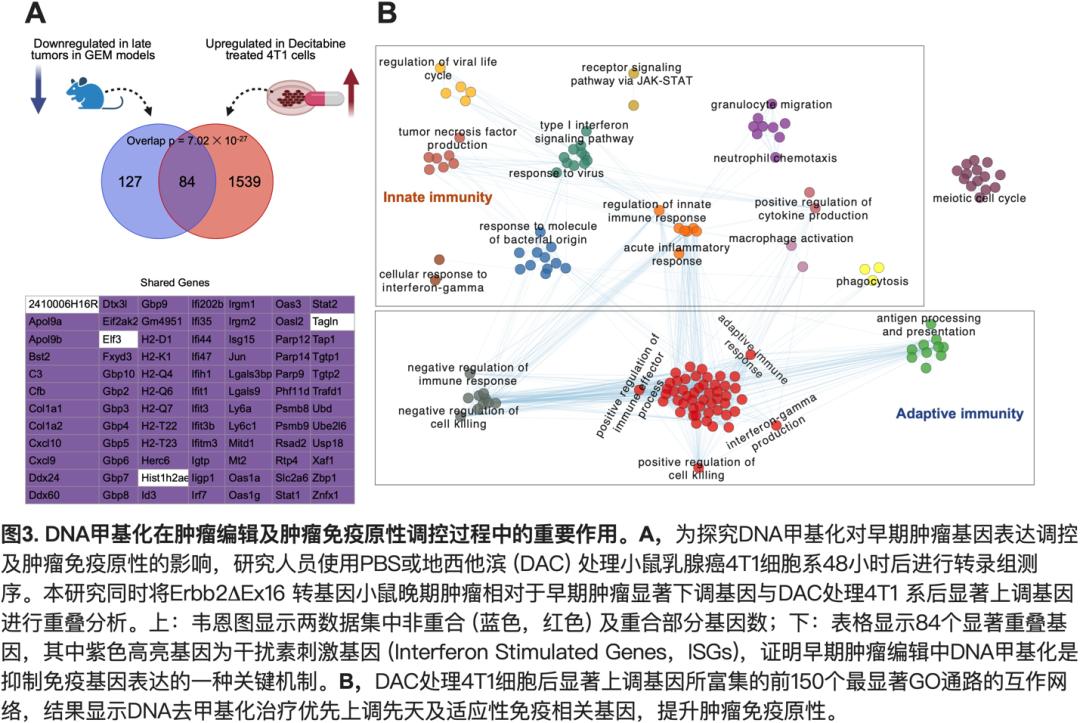
表观遗传修饰是调控肿瘤中基因表达的重要机制,其中DNA甲基化可抑制多种免疫基因表达。为探究早期肿瘤编辑的作用机制,研究团队利用携带乳腺癌或黑色素瘤的多种自发或同源移植肿瘤小鼠模型,使用低剂量DNA甲基转移酶抑制剂地西他滨(Decitabine,DAC)治疗。结果显示DAC可强效抑制肿瘤生长甚至治愈以形成的转基因小鼠肿瘤, 同时高效提升抗肿瘤免疫力,增加肿瘤微环境中杀伤淋巴细胞的数量及功能,增加具有更强肿瘤杀伤能力的组织驻留记忆CD8+ TIL6及负责抗原交叉呈递激活CD8+ T细胞的经典I型树突细胞7的数量,同时大幅降低髓系抑制性细胞的数量。进一步研究发现, 在携带ErbB2Ex16或4T1原位乳腺癌,或B16F10黑色素瘤的荷瘤鼠中使用低剂量DAC治疗可显著提升多种先天免疫基因表达,包括参与炎性细胞死亡、炎性细胞因子及I型干扰素(IFN-I)信号通路的不同关键基因。同时,研究团队对低剂量DAC处理的乳腺癌细胞系进行转录组测序,发现DAC主要上调基因表达。令人意想不到的是,DAC上调基因几乎完全富集于能够提升肿瘤免疫原性的免疫相关通路(图3)。DAC最显著上调的基因主要富集在IFN 信号转导、 炎症细胞因子及T细胞免疫相关重要途径、以及炎性细胞死亡途径(包括细胞焦亡和坏死性凋亡)。重要的是,分析发现DAC在乳腺癌细胞中上调的基因与转基因小鼠肿瘤从早期向晚期发展过程中下调的基因显著重叠(图3.A)。重叠基因大多是干扰素诱导基因(Interferon stimulated genes,ISG),参与所有主要的先天及适应性免疫通路。重叠基因最显著富集的前 22个GO为先天免疫途径, 表明优先沉默关键先天免疫途径是免疫编辑降低肿瘤免疫原性的主要方式, 而DNA甲基化是早期肿瘤免疫编辑的重要机制之一。
该研究同时发现, DAC治疗能在肿瘤内高效激活炎性癌细胞死亡, 包括膜打孔蛋白GSDME介导的细胞焦亡以及RIPK3介导的坏死性凋亡。尽管DAC处理肿瘤细胞中IFN-I信号通路相关基因上调最为显著,利用DAC治疗IFN-I受体Ifnr敲除的小鼠并未显著影响其抗肿瘤能力。敲除肿瘤细胞中的Gsdme、Ripk3、或IFN-I通路关键转录因子Irf3/7均可显著削弱DAC抑制肿瘤生长及激活抗肿瘤免疫力的能力, 表明多种先天免疫通路(干扰素、焦亡和坏死性凋亡)的激活都可作为危险信号招募并激活杀伤淋巴细胞,诱导有效的抗肿瘤免疫反应并增强免疫系统对肿瘤的控制。
综上,该研究详细刻画了早期乳腺癌中的肿瘤编辑进程,揭示了肿瘤编辑对关键先天免疫途径的优先抑制及其在调控肿瘤免疫原性中的重要性,阐释了DNA甲基化在肿瘤免疫编辑中发挥的关键作用并证明了通过DAC抑制DNA甲基化的抗癌潜能及作用机理。该研究提示,通过靶向性地表观遗传调控提升肿瘤中关键先天免疫途径的活性有潜力促进肿瘤由“冷”转“热”,为提升抗肿瘤免疫力及开发高效免疫治疗新策略提供了新思路。
北京大学生命科学学院、北大-清华生命科学联合中心张莹研究员与哈佛大学医学院博士后Pourya Naderi Yeganeh为论文第一作者。北京大学生命科学学院、北大-清华生命科学联合中心张莹研究员、哈佛大学医学院Winston Hide教授及Judy Lieberman教授为论文通讯作者。该研究得到北大-清华生命科学联合中心,北京大学生命科学学院及细胞增殖与分化教育部重点实验室的大力支持和资助。
论文链接:
https://www.nature.com/articles/s41590-024-01932-8

