【前沿进展】PNAS丨汪方炜/颜海燕/张龙合作揭示黏连蛋白功能的重要调控机制
黏连蛋白(Cohesin)是一个在进化上高度保守的环状结构复合体,参与调控一系列基于DNA和染色质的重要生物学过程(图1)。黏连蛋白可以拓扑联结两个DNA分子,通过介导姐妹染色单体粘连(sister chromatid cohesion)调控染色体分离、DNA复制和同源重组DNA修复,进而维护基因组稳定性。黏连蛋白还可以拓扑结合单个DNA分子,通过形成染色质环(chromatin loop)调控基因组三维构象和基因转录【1】。黏连蛋白的突变常见于癌细胞中,与癌症等疾病的发生发展密切相关。
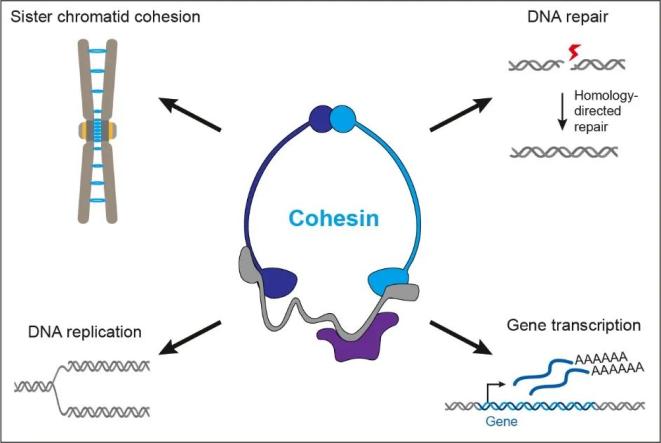
图1:黏连蛋白参与调控的重要生物学过程。
黏连蛋白复合体由Smc1、Smc3、Scc1和SA2(或旁系同源蛋白SA1)四个核心亚基组成,其中Smc1、Smc3和Scc1三者首尾相连形成环状结构,而SA2则像是镶嵌在戒指上的钻石结合于Scc1的中间区域(图2)。Smc3与Smc1的铰链区(Hinge)互作界面、Smc3头部结构域(Head)与Scc1氨基端的互作界面分别构成DNA进出黏连蛋白环的通道。黏连蛋白环的DNA出口(即Smc3-Scc1互作界面)的开放依赖于黏连蛋白释放因子Wapl【2-4】。一个长期悬而未决的科学问题是,Wapl如何打开黏连蛋白环的DNA出口进而调控黏连蛋白功能,而解决这个问题的关键在于探明Wapl如何结合黏连蛋白复合体的核心亚基。
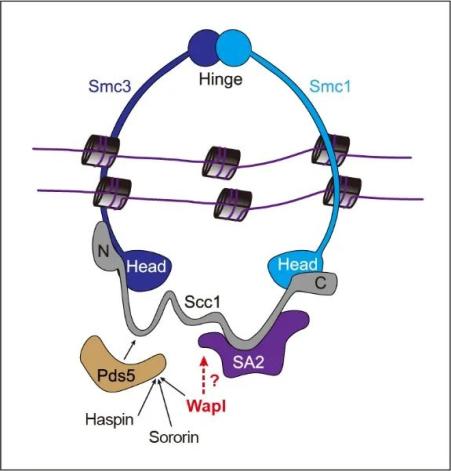
图2:介导姐妹染色单体粘连的黏连蛋白复合体。Wapl可与Sororin、Haspin等蛋白竞争性结合黏连蛋白的调节亚基Pds5,进而影响黏连蛋白与DNA的结合状态【5-7】。Wapl结合黏连蛋白核心亚基的机制尚不清楚。
2024年8月7日,浙江大学生命科学研究院汪方炜团队与浙大城市学院医学院颜海燕团队、浙江大学生命科学研究院张龙团队合作,在PNAS发表了题为Molecular mechanism and functional significance of Wapl interaction with the Cohesin complex的研究论文,解析了黏连蛋白功能的重要调控机制(图3)。

图3:论文首页截图。
在该项研究中,作者们通过GST pull-down、免疫共沉淀和细胞内异位定位等一系列体内外蛋白互作实验,并结合AlphaFold2蛋白质结构预测与验证,发现Wapl分别通过FGF基序和YNARHWN基序结合黏连蛋白核心亚基Scc1与SA2互作界面的不同区域(图4)。单独破坏FGF基序或YNARHWN基序与Scc1-SA2界面的结合仅部分减弱Wapl与Scc1-SA2界面的结合,并部分削弱Wapl从染色体上移除黏连蛋白的能力。当这两个结合基序被同时突变后,Wapl几乎不能结合黏连蛋白核心亚基,使得黏连蛋白异常紧密地结合DNA,进而阻碍有丝分裂期姐妹染色单体粘连的及时解除,导致染色体分离错误。此外,FGF基序和YNARHWN基序的叠加突变还会造成细胞分裂间期染色质异常凝缩,提示了三维基因组结构的改变。
以上结果说明,Wapl通过两个独立的结构模块同时结合黏连蛋白核心亚基Scc1与SA2的互作界面,赋予Wapl从染色质上移除黏连蛋白的最大活性,从而确保了有丝分裂期染色体精确分离,以及分裂间期细胞中基因组的正常三维结构。
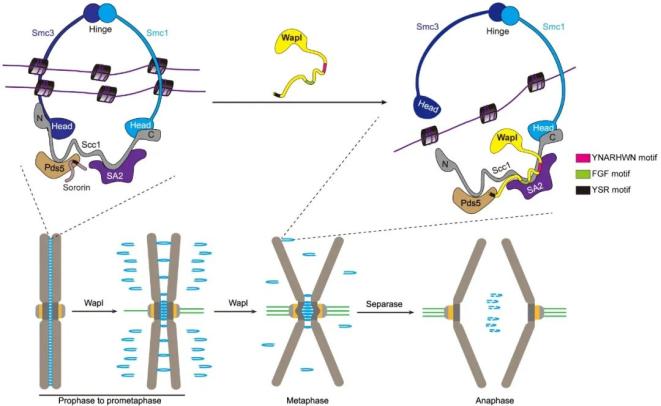
图4:Wapl通过FGF基序和YNARHWN基序结合黏连蛋白核心亚基Scc1-SA2的互作界面,促进黏连蛋白环DNA出口的打开,进而从染色体臂部移除黏连蛋白。
众所周知,有丝分裂期染色体着丝粒区的黏连蛋白不能被Wapl移除。那么,Wapl的活性在着丝粒区又是如何被拮抗的呢?先前的研究表明,Sgo1在保护着丝粒区黏连蛋白中发挥重要作用。作者们发现,类似于Wapl的FGF基序与Scc1-SA2的相互作用,Sgo1利用其YNF基序结合Scc1-SA2界面。功能研究发现,当YNF基序被突变为不能结合Scc1-SA2界面的ANA后,Sgo1保护黏连蛋白的活性大幅下降。有意思的是,Sgo1的YNF基序只能与Wapl的FGF基序竞争结合Scc1-SA2界面,而不能与Wapl的YNARHWN基序竞争。以上结果提示,着丝粒区可能存在一个含有YNARHWN基序的蛋白,该蛋白与Sgo1以及内层动粒蛋白CENP-U(包含一个可以结合Scc1-SA2界面的FDF基序)协同作用8,充分抑制了Wapl与着丝粒区黏连蛋白核心亚基的结合。
综上所述,这项研究揭示了Wapl结合黏连蛋白复合体核心亚基的分子基础和功能,为受黏连蛋白调控的染色体行为和生物学功能研究提供了新的见解,并为黏连蛋白突变促进癌变的转化研究奠定了重要基础。
袁雪颖博士、颜璐、陈亲富研究员为论文的共同第一作者,汪方炜教授、颜海燕副教授和张龙教授为共同通讯作者。朱叔楷、周欣雨、曾玲晖教授、刘明洁博士、贺晓静教授、黄俊教授和吕卫国教授也有重要贡献。
原文链接:
https://www.pnas.org/doi/10.1073/pnas.2405177121
来源:BioArt
参考文献
1. Hoencamp, C. & Rowland, B.D. Genome control by SMC complexes. Nat Rev Mol Cell Bio 24, 633-650 (2023).
2. Kueng, S. et al. Wapl controls the dynamic association of cohesin with chromatin. Cell 127, 955-967 (2006).
3. Tedeschi, A. et al. Wapl is an essential regulator of chromatin structure and chromosome segregation. Nature 501, 564-568 (2013).
4. Haarhuis, J.H.I. et al. The Cohesin Release Factor WAPL Restricts Chromatin Loop Extension. Cell 169, 693-707 e614 (2017).
5. Nishiyama, T. et al. Sororin mediates sister chromatid cohesion by antagonizing Wapl. Cell 143, 737-749 (2010).
6. Ouyang, Z., Zheng, G., Tomchick, D.R., Luo, X. & Yu, H. Structural Basis and IP6 Requirement for Pds5-Dependent Cohesin Dynamics. Mol Cell 62, 248-259 (2016).
7. Zhou, L. et al. The N-Terminal Non-Kinase-Domain-Mediated Binding of Haspin to Pds5B Protects Centromeric Cohesion in Mitosis. Curr Biol 27, 992-1004 (2017).
原标题:《【前沿进展】PNAS丨汪方炜/颜海燕/张龙合作揭示黏连蛋白功能的重要调控机制》

