【前沿进展】专家点评Neuron | 陈万金/熊志奇/程学文团队合作开发首个脑钙化症反义核苷酸疗法
点评 | 鲁伯埙(复旦大学)
人类社会人口老龄化进程导致衰老相关疾病负担急剧增加。在机体衰老过程中,骨骼钙丢失可引起骨质疏松,而血管与大脑等组织中出现的异位钙化,可导致心血管与脑功能障碍。脑钙化在60岁以上老年人群发生率高达20%。生理性脑钙化斑块较小且进展缓慢;但病理性脑钙化症发病早、进展快,可出现严重的神经与精神症状,如运动障碍、言语不清、痴呆、头痛、头晕、抑郁和睡眠障碍等。部分脑钙化患者呈高度家族性遗传,如原发性家族性脑钙化症(PFBC),患病率介于0.2%至0.6%之间,通常在40至60岁发病。目前临床尚无可干预脑钙化病理进程的药物。与其它神经退行性疾病(如老年痴呆)类似,脑钙化症的自然病程从出现脑钙化病理到发生脑功能障碍之间存在时间差。轻度脑钙化患者就诊率低,延误最佳的治疗时机。推动社会大众对脑钙化的认知是早期诊断和早期干预的基础。
2024年8月8日,福建医科大学附属第一医院陈万金教授、临港实验室程学文副研究员与中国科学院脑科学与智能技术卓越创新中心、上海脑科学与类脑研究中心熊志奇研究员团队合作,在Neuron上发表了题为Antisense oligonucleotides enhance SLC20A2 expression and suppress brain calcification in a humanized mouse model的研究论文。该研究发现调控脑内磷酸根浓度的关键基因、同时也是脑钙化症主要致病基因SLC20A2存在着新型可变剪接调节机制,并据此开发了反义寡聚核苷酸疗法,可在患者来源的细胞和人源化小鼠模型上有效恢复SLC20A2基因的表达,并显著遏制脑钙的化进展,是首个基于底层病因修复的脑钙化干预疗法。
 得益于临床专家和基础科学家的长期紧密合作,我国在脑钙化症致病基因的鉴定与研究领域处于国际引领地位。2012年,我国学者刘静宇研究员鉴定了PFBC首个显性突变致病基因SLC20A2 (Nature Genetics, 2012);2018-2022年,陈万金教授和熊志奇研究员团队合作发现脑钙化隐性突变致病基因MYORG和CMPK2 (Neuron, 2018; Cell Discovery, 2022);罗巍教授发现JAM2基因(Brain, 2020)。SLC20A2基因编码一种钠磷共转运体PiT2,其杂合突变是最常见的脑钙化致病原因,占所有已报道遗传性脑钙化病例的60%,导致PiT2表达单倍体剂量不足,患者脑脊液无机磷(Pi)水平显著上调和脑钙化发生。
得益于临床专家和基础科学家的长期紧密合作,我国在脑钙化症致病基因的鉴定与研究领域处于国际引领地位。2012年,我国学者刘静宇研究员鉴定了PFBC首个显性突变致病基因SLC20A2 (Nature Genetics, 2012);2018-2022年,陈万金教授和熊志奇研究员团队合作发现脑钙化隐性突变致病基因MYORG和CMPK2 (Neuron, 2018; Cell Discovery, 2022);罗巍教授发现JAM2基因(Brain, 2020)。SLC20A2基因编码一种钠磷共转运体PiT2,其杂合突变是最常见的脑钙化致病原因,占所有已报道遗传性脑钙化病例的60%,导致PiT2表达单倍体剂量不足,患者脑脊液无机磷(Pi)水平显著上调和脑钙化发生。在本次工作中,团队采用全基因组测序(WGS)从数百个脑钙化患者中发现了六个脑钙化家系携带SLC20A2基因的内含子突变,并发现SLC20A2基因内含子区域存在着隐蔽外显子序列(Cryptic exon),且其中包含着提前终止密码子(PTC)。正常情况下,一条染色体上的SLC20A2转录产物,有近一半整合有隐蔽外显子序列;在流水线一样的mRNA加工过程中,这部分携带有PTC标签的不合格mRNA转录本会被细胞内的质检机制降解。然而,内含子序列变异造成该条染色体上几乎所有SLC20A2 pre-mRNA序列均变成不合格品,造成患者PiT2表达不足和脑内Pi稳态失衡, 最终导致脑钙化发生。基于此原理构建的整合人源化突变内含子序列的脑钙化模型小鼠,出现了脑脊液磷酸根水平升高和年龄依赖的脑钙化,模拟了PFBC患者的病理表型。
在此基础上,研究团队设计筛选了靶向SLC20A2隐蔽外显子序列的反义寡核苷酸(ASO)药物。在SLC20A2杂合突变患者来源的人成纤维细胞上,ASO干预可以显著上调SLC20A2的mRNA和蛋白质表达。人源化小鼠模型脑室内一次ASO给药,可以实现持续4个月以上的SLC20A2表达修复。此外,ASO可以降低脑钙化小鼠的脑脊液 Pi水平,并显著抑制脑钙化的发生与进展。此外,脑钙化沉积和磷稳态失衡引起的神经元退行性病变、神经炎症等病理变化也可以被ASO有效改善。
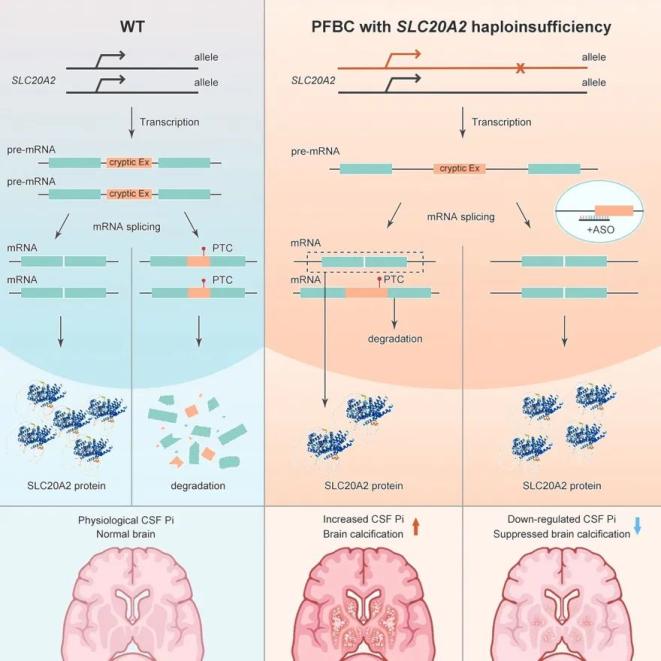 图1. 脑钙化致病基因SLC20A2的可变剪接机制以及ASO疗法的干预原理示意图
图1. 脑钙化致病基因SLC20A2的可变剪接机制以及ASO疗法的干预原理示意图陈万金与熊志奇团队致力于从新的致病基因鉴定入手,解析神经疾病机理并研发创新性干预方案。自2018年鉴定脑钙化第一个隐性遗传致病基因MYORG(Neuron, 2018),通过MYORG特异表达于星型胶质细胞这一现象,揭示了星形胶质细胞调控脑内磷酸根离子稳态和脑钙化发生发展的机制(Neuron, 2024a)。本次研究进展也正是从鉴定出脑钙化家系携带的内含子突变出发,揭示脑钙化症致病基因SLC20A2的新型可变剪接调节机制,并开发了基于ASO的脑钙化症干预方案(Neuron, 2024b),是前期合作成果的延续与突破,也是基础研究“源自临床、回馈临床”的成果体现。该ASO干预策略为脑内磷稳态失衡相关的脑钙化患者提供了一种有前景的治疗方法,并有望拓展到其它适应症。
福建医科大学附属第一医院赵淼博士、临港实验室程学文副研究员、临港实验室陈蕾博士、福建医科大学附属第一医院博士生曾一恒和林凯俊为论文共同第一作者。陈万金教授、熊志奇研究员、程学文副研究员为共同通讯作者。福建医科大学附属第一医院王柠教授、中国科学院脑科学与智能技术卓越创新中心刘静宇研究员和杨辉研究员为该研究提供了大力支持和指导。空军军医大学唐都医院郭俊主任、贵州医科大学附属医院贺电主任和刘瑛主任、希望组生物科技公司操振华、鲁兵利提供了临床样本研究帮助。
专家点评
鲁伯埙(复旦大学教授)
公众从媒体可以经常了解到阿尔兹海默氏症(AD)和帕金森氏症(PD)这些神经退行性疾病,其实神经退行性疾病还有其它多种类型,这符合人体多维复杂性和衰老的多因素交互影响的基本属性。国际社会在AD和PD等退行性疾病的研究上投入了大量人力物力,但目前还缺乏有效的病因性的干预药物。相对而言,遗传性神经退行性疾病近些年有很多积极的进展。除了我从事研发的亨廷顿疾病,国内在其它神经退行性罕见病方面的有趣发现也是令人欣喜的。陈万金教授、熊志奇研究员、程学文博士和赵淼博士在脑钙化症方面的十余年合作研究,从发现星形胶质细胞特异表达的MYORG基因(Neuron, 2018)和线粒体功能相关的CMPK2基因(Cell Discovery),到揭示星形胶质细胞在维持脑内磷稳态的关键作用与机制(Neuron, 2024a),以及此次工作开发了治疗脑钙化的新型基因疗法(Neuron, 2024b),推动了原发性脑钙化症在基因-机制-治疗方面体系化的进展,实现了“临床-基础-临床”的闭环创新,奠定我国在脑钙化的遗传机制、疾病机理与药物研发处于世界领先地位。PFBC这个疾病,从1930年德国医生Theodor Fahr正式定义到现在近100年,今天终于迎来有希望的突破性疗法。这种临床与基础合作、自主持续创新的、兼有科学和临床意义的工作,塑造了一种合作研究范式的代表性案例。具体到反义寡聚核苷酸(ASO)疗法,目前治疗脊髓性肌萎缩症(SMA)和杜氏肌营养不良症(DMD)的ASO药物已经获批上市,处于临床试验阶段的应用于阿尔茨海默病(AD)、肌萎缩性脊髓侧索硬化症(ALS)、天使综合症等的ASO药物管线还有很多;和分子胶技术类似,都是当前研发比较活跃的新型药物技术之一。从该工作的发现看,这是值得重视和期待的一种药物形态,希望这个疗法将来能够真正造福众多脑钙化症患者。
原文链接:
https://www.cell.com/neuron/abstract/S0896-6273(24)00535-X
来源:BioArt
参考文献
1. Wang, C., Li, Y., Shi, L., Ren, J., Patti, M., et al. (2012). Mutations in SLC20A2 link familial idiopathic basal ganglia calcification with phosphate homeostasis. Nature genetics 44, 254-256.
2. Yao, X.P., Cheng, X., Wang, C., Zhao, M., Guo, X.X., et al. (2018). Biallelic Mutations in MYORG Cause Autosomal Recessive Primary Familial Brain Calcification. Neuron 98, 1116-1123.e1115.
3. Cen, Z., Chen, Y., Chen, S., Wang, H., Yang, D., et al. (2020). Biallelic loss-of-function mutations in JAM2 cause primary familial brain calcification. Brain : a journal of neurology 143, 491-502.
4. Zhao, M., Su, H.-Z., Zeng, Y.-H., Sun, Y., Guo, X.-X., et al. (2022). Loss of function of CMPK2 causes mitochondria deficiency and brain calcification. Cell Discovery 8, 128.
5. Cheng, X., Zhao, M., Chen, L., Huang, C., Xu, Q., et al. (2024). Astrocytes modulate brain phosphate homeostasis via polarized distribution of phosphate uptake transporter PiT2 and exporter XPR1. Neuron. Jul 9:S0896-6273(24)00455-0.
6. Zhao, M., Cheng, X., Chen, L., Zeng, Y.-H., Lin, K.-J., et al. (2024). Antisense oligonucleotides enhance SLC20A2 expression and suppress brain calcification in a humanized mouse model. Neuron.
原标题:《【前沿进展】专家点评Neuron | 陈万金/熊志奇/程学文团队合作开发首个脑钙化症反义核苷酸疗法》

