Cell:吴军/杨辉/郭帆/周海波团队在小鼠体内生成大鼠前脑组织
异种嵌合体由不同物种的细胞构成,是研究基因功能与细胞发育机制的重要资源。这一研究领域因其在缓解全球器官供应短缺问题上的潜在价值而受到关注。通过一项名为异种囊胚互补(Interspecies blastocyst complementation)的技术,研究人员能够在宿主动物体内培养出另一个物种的器官。这种技术涉及将供体的多能干细胞注入一个缺少关键发育基因的宿主囊胚中,使得供体细胞能够补充宿主所缺失的器官或组织,从而在一个物种中培育出异种器官。
以往的研究已经在小鼠体内成功培育出大鼠的胰腺、胸腺、血管内皮组织和生殖细胞,以及在大鼠中培育出小鼠的胰腺、肾脏和生殖细胞。然而,尚未有研究实现在异种培育大脑组织。在一种物种中生成另一种物种的大脑组织能够帮助科学家在进化的背景下研究大脑的发育和功能。
2024年4月25日,德克萨斯大学西南医学中心吴军团队、中国科学院脑科学与智能技术卓越创新中心杨辉/周海波团队和中国科学院动物研究所郭帆团队合作,在 Cell 期刊发表了题为:Generation of rat forebrain tissues in mice 的研究论文。
该研究开发了一种名为C-CRISPR based Blastocyst Complementation(CCBC)的囊胚互补技术,利用该技术在小鼠胚胎上筛选出支持前脑囊胚互补的基因Hesx1,并成功在小鼠体内生成了功能性大鼠胚胎干细胞来源的前脑组织。
异种前脑互补为研究大脑发育以及认知功能机制在进化上的保守和差异性打开了大门。优化的囊胚互补策略具有极大的潜力,可以拓宽异种器官生成的研究和应用。

传统的囊胚互补技术通常涉及构建携带影响特定器官发育的杂合突变小鼠,然后繁殖这些小鼠以获得基因突变的囊胚。随后,将供体细胞注入这些突变囊胚中,以产生囊胚互补嵌合体。这个过程不仅耗时耗力,且对于致死性杂合突变基因不适用。在本研究之前,还未报道可以支持异种前脑囊胚互补的基因。采用传统方法来验证某一基因是否能支持前脑囊胚互补通常是一个漫长的过程,即便是对于小鼠这样孕期较短且性成熟较快的物种也需10-26个月。对于生殖周期更长的家畜或非人类灵长类动物,这一过程更加复杂和困难。
为解决这些局限,研究团队引入了C-CRISPR(Cocktail of targeting sgRNAs in the CRISPR/Cas9 system)技术,通过多个gRNA与Cas9结合,实现了接近100%的目标基因敲除效率。通过将C-CRISPR技术与囊胚互补技术相结合,研究团队开发出了一种新型囊胚互补系统,称为CCBC(C-CRISPR based Blastocyst Complementation)。这一系统可以快速测试目标基因是否适用于囊胚互补,并能一步完成器官重构嵌合体的生成。
在早期脊椎动物胚胎发育中,头部形态的形成已知依赖于Wnt/β-catenin信号传导路径。利用CCBC技术,研究者筛选了七个已知在脑发育期间调节Wnt信号的基因。这些基因都能被C-CRISPR技术有效地敲除,但仅有Dkk1、Hesx1和Six3基因的缺失导致了前脑发育不全(图1A)。在将小鼠胚胎干细胞(mESCs)注入到这些敲除基因的囊胚中后,研究团队在敲除Dkk1和Hesx1的胚胎中观察到了同种前脑组织的重构(图1B)。

图1. 利用CCBC进行前脑囊胚互补基因筛选。A:基因敲除后E12.5小鼠胚胎表型;B:mESCs对不同突变胚胎的前脑补偿。
为了确定是否可以通过CCBC在小鼠中生成大鼠前脑组织,研究者将大鼠胚胎干细胞(rESCs)注入到Hesx1-/-小鼠囊胚中。在出生的417只Hesx1-/- +rESCs嵌合体中,401只为部分前脑重构(96.16%),16只为完全前脑重构(3.84%)(图2A)。研究团队发现,在Hesx1-/- +rESCs嵌合体中,tdTomato+细胞的比例在皮层和海马区比其他脑区和组织更高(图2B)。
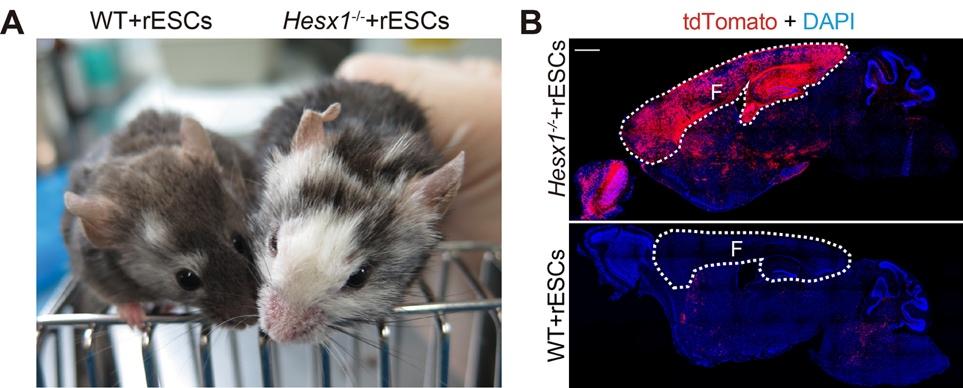
图2. 通过CCBC在小鼠体内生成大鼠前脑组织。A: 基于CCBC的异种前脑互补嵌合体;B: 表达tdTomato的大鼠细胞对前脑组织的嵌合占比
所有Hesx1-/- +rESCs和Hesx1-/- +mESCs嵌合体都存活至成年,并呈现与传统嵌合体(野生型囊胚+mESCs,WT+mESCs)相近的体重增长曲线。在这些嵌合体的大脑皮层V层和海马中,均检测到表达CTIP2的细胞。各组嵌合体间皮层和海马的厚度及细胞密度也显示出相似性。
为了评估来自rESCs的神经元的功能,研究团队将AAV8-hSyn-EGFP注入到Hesx1-/- +rESCs前脑的前侧运动皮层。观察结果显示,由rESCs衍生的前脑神经元能够向后发送轴突,投射至丘脑、上丘和脑干中脑区域。电生理研究进一步证明了嵌合前脑中,无论是大鼠还是小鼠的皮质神经元都能随着电流注入量的增加产生不同频率的动作电位。嵌合体中能观察到大鼠-小鼠、小鼠-小鼠、大鼠-大鼠神经细胞之间存在突触连接。
研究通过行为学测试,包括Morris水迷宫实验、开放场测试和情境恐惧记忆测试,评估了同种和异种前脑补偿嵌合体的前脑功能。测试结果显示,WT+mESCs、Hesx1-/- +rESCs和Hesx1-/- +mESCs嵌合体在这些行为测试中的表现无显著差异,表明重建的前脑功能表现正常。这些结果表明Hesx1-/-小鼠胚胎为供体rESCs提供了适宜的发育环境,帮助其形成功能性的大鼠前脑组织。
单细胞RNA测序显示,在Hesx1-/- +rESCs嵌合体中,大鼠细胞形成了多种类型的神经细胞,种类和比例接近于正常大鼠的前脑组织。大鼠细胞的转录组更接近于WT大鼠细胞。有趣的是,早期胚胎的切片结果显示,大鼠细胞形成的前脑组织的尺寸和发育进度与宿主小鼠一致,这表明非细胞自主机制决定了器官的大小和发育速度,而细胞自主机制塑造了嵌合体中大鼠前脑组织的整体转录组特征。
通过比较嵌合体与WT大鼠中大鼠细胞的转录组差异,研究者发现了一些与轴突生成、前脑发育和神经生成调控等相关的差异表达基因。通过细胞相互作用分析,该研究观察到了多种潜在的配体-受体相互作用,这可能解释了宿主Hesx1-/-小鼠细胞如何影响供体大鼠细胞,以及帮助它们在前脑中的存活和分化。
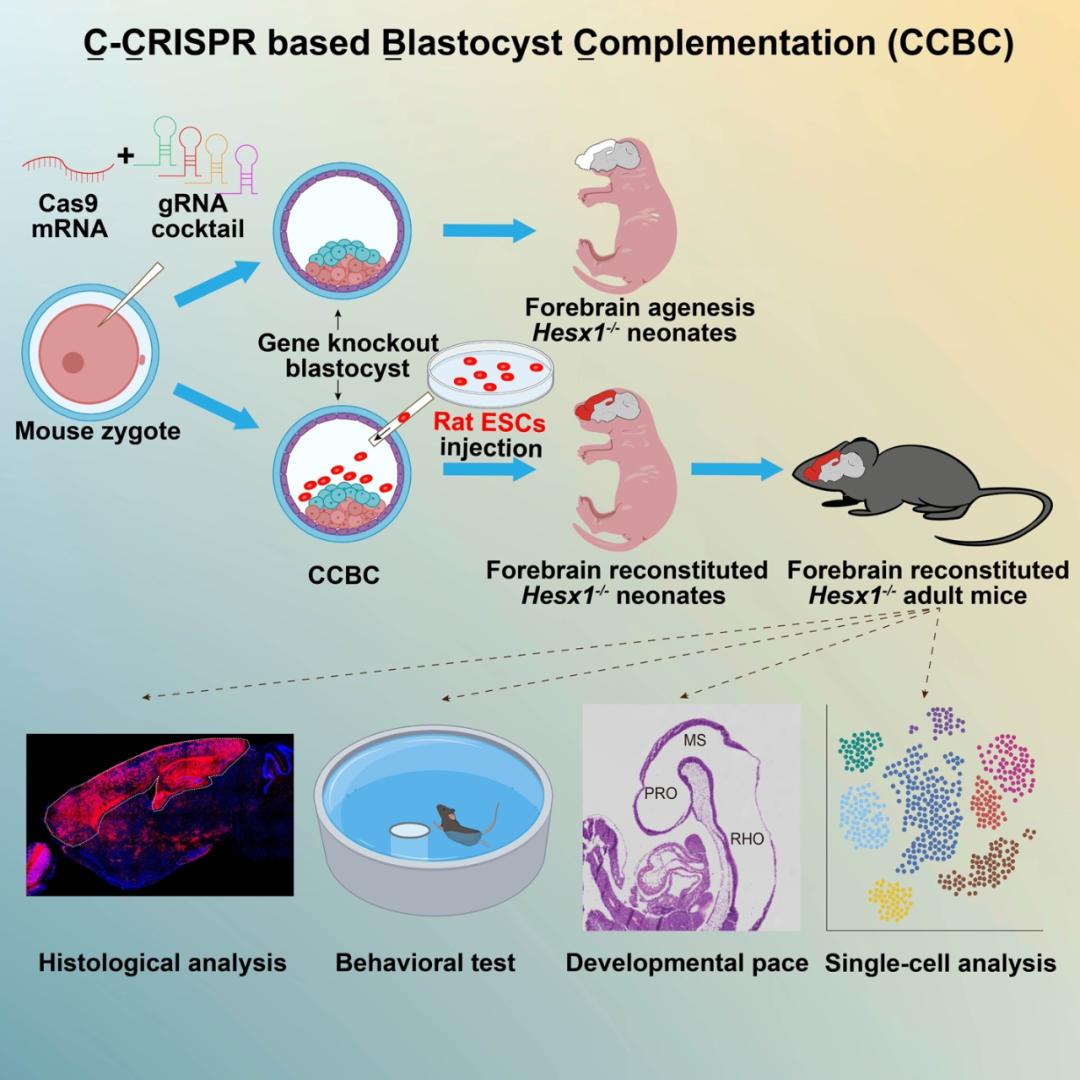
综上,该研究开发了一种高效的一步法CCBC平台,证明了在小鼠囊胚中敲除Hesx1能够支持小鼠和大鼠干细胞重构前脑组织,展示了来源于mESCs和rESCs的神经元能在小鼠前脑中功能性地整合。揭示了异种前脑补偿嵌合体里脑组织的尺寸、密度发育速度与宿主一致,在转录组水平上大鼠细胞在小鼠胚胎里仍能维持自身的转录组特征。异种嵌合体技术不仅能够用于器官再生,还为研究脑相关基因调控网络、神经细胞间的通信以及在进化背景下的大脑功能提供了新的研究途径。
德克萨斯大学西南医学中心终身教授吴军、中国科学院脑科学与智能技术卓越创新中心杨辉、周海波和中国科学院动物研究所郭帆为该论文共同通讯作者。德克萨斯大学西南医学中心博士后黄佳、贺冰冰、李磊杰,中国农科院深圳农业基因组研究所博士生杨霞丽,中国科学院动物研究所博士生龙鑫以及中国科学院脑科学与智能技术卓越创新中心博士后魏迎辉为该论文共同第一作者。
论文链接:
https://www.cell.com/cell/abstract/S0092-8674(24)00308-8

