【科技前沿】Protein & Cell综述 | 透过相分离和相变镜头重新思考疾病与药物研发
由多价相互作用驱动的生物分子凝聚体在细胞内充当了一种调控细胞基本生命活动的普遍机理。对凝聚体平衡微妙的干扰,无论是相分离的增加还是减少,都与生理功能异常或紊乱息息相关。随着基础科学广泛的拥抱这一全新的认知,我们对疾病的理解正悄然发生变革。回顾过去的十几年,在揭示异常相分离与各种疾病之间深刻相关性和潜在因果关系方面,世界范围内的科学家们取得了显著进展。
2023年12月9日,清华大学李丕龙教授团队在Protein & Cell上发表了综述文章Long way up: rethink diseases in light of phase separation and phase transition。本篇综述尝试总结领域内的工作进展,着重阐述异常相分离与神经退行性疾病、癌症和传染性疾病之间错综复杂的关联。更重要的是,文章总结了第一批“先行者”提出的基于生物分子凝聚体发展的方法论,用于开发与异常相分离相关疾病的药物以及普遍适用的技术平台。
 在探究疾病机制的过程中,经常将引发疾病的基因突变分为功能丧失或功能增强,本文将由疾病突变引起的异常相分离分类为相分离丧失(Loss of phase separation: LoPS)和相分离增强(Gain of phase separation : GoPS)(图1)。简而言之,我们定义有缺陷的凝聚体在表现出有限的相分离能力甚至解体时属于LoPS。相反,GoPS表示那些具有新获得的相分离或过度状态(凝胶或固体)的凝聚体(图1)。
在探究疾病机制的过程中,经常将引发疾病的基因突变分为功能丧失或功能增强,本文将由疾病突变引起的异常相分离分类为相分离丧失(Loss of phase separation: LoPS)和相分离增强(Gain of phase separation : GoPS)(图1)。简而言之,我们定义有缺陷的凝聚体在表现出有限的相分离能力甚至解体时属于LoPS。相反,GoPS表示那些具有新获得的相分离或过度状态(凝胶或固体)的凝聚体(图1)。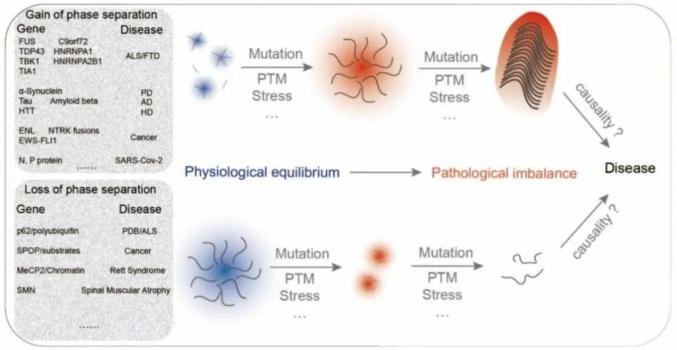 图1
图11 异常相分离与神经退行性疾病,癌症,感染性疾病
神经退行性疾病在全球医疗系统中的负担不断增加。这些疾病包括阿尔茨海默病(AD)、肌萎缩性侧索硬化症(ALS)、弗氏共济失调(FA)、额颞叶痴呆(FTD)、亨廷顿病(HD)、帕金森病(PD)。在过去几十年中,大量证据表明蛋白质异常聚集是其中一些疾病的标志性特征,涉及蛋白质如TDP-43、FUS、Tau、hnRNPA1、hnRNPA2B1、富含多谷氨酸(polyQ)的蛋白质和TIA1等,这些蛋白质通过异常相分离导致的生物物理性质发生不可逆地改变。在目前神经退行性疾病在基础研究领域内机制尚未十分清楚的大背景下,我们迫切需要深入了解这些疾病的发生和发展机制,以及寻找革新式的干预手段。其中,异常相分离的研究为我们提供了一个全新的视角。研究者可以进一步探讨蛋白质异常相分离的分子机制、生物学效应以及与疾病进展的关联。这种全面的探索不仅有助于解锁神经退行性疾病的谜团,还为未来研究提供了深入挖掘的方向。在这一过程中,我们可以加强对与神经退行性疾病相关的蛋白质异常相分离的详细研究,特别是关注这些现象如何与其他细胞过程相互作用,以促使疾病的发展。此外,我们还可以深入研究这些相分离事件的时空动态,了解它们在疾病进展的不同阶段的变化。通过这些细致入微的研究,我们可以建立更全面、精准的神经退行性疾病模型,有助于更好地理解它们的发生和发展机制。
癌症相关的复杂基因突变导致了从分子水平到生物体水平的巨大功能紊乱。尽管癌症具有遗传异质性,但它表现出诸如异常细胞增殖、侵袭、转移和代谢等共同特征。然而,在癌症治疗方面仍存在显著的局限性。相分离的概念可以提供一种新的视角,以理解癌症的复杂特征。例如,白血病蛋白(ENL)作为组蛋白乙酰化的“读取器”,与肿瘤相关的突变导致了微米级凝聚体的形成,增强了转录活性进而促发肿瘤。此外,无序结构域与DNA结合结构域的融合导致相分离获得类型的融合基因,包括Ewing肉瘤中EWSR1的N末端无序区域和FLI-1的DNA结合结构域,以及脂肪肉瘤中FUS的N-末端无序区域和转录因子CHOP,致使下游基因调控发生巨大变化,促发恶性肿瘤发生。另一重要例子,肿瘤抑制基因SPOP(speckle-type POZ protein)的肿瘤相关突变通常发生在底物结合meprin和TRAF同源结构域中。Mittag及其同事发现SPOP和底物的相分离依赖于多价相互作用,这些相互作用被癌症突变破坏,SPOP的异常相分离提供了理解遗传变异的全新视角。
感染性疾病领域中,生物分子凝聚体在塑造细胞组分的时空组织中发挥着重要作用。病原体常常利用这些凝聚体的形成来增强它们的传染性,而宿主防御机制则利用这些结构来检测和中和病原体。由病毒蛋白协调的凝聚体的一个功能上重要的表现是形成通常被称为“复制区”(RCs)或“包涵体”(IBs)的结构。RCs是专门的站点,用于进行病毒复制和组装过程,促进特定病毒和细胞蛋白质以及核酸的浓缩。这些区域充当平台,通过选择性包含或排除组分并保护免受宿主免疫防御,优化病毒复制。此外,先天免疫响应方面,当细胞表面或细胞内模式识别受体识别外源的与病原相关的分子模式(PAMPs)时,先天免疫信号被启动,从而触发免疫应答。一个突出的例子是细胞质DNA传感器,环状GMP-AMP合酶(cGAS),在识别PAMPs时表现出形成液滴状结构的趋势。这种相分离现象不仅有助于cGAMP的产生,还促进了先天免疫信号传导。干扰素刺激基因(ISGs),包括PKR,ADAR1,RNA感知的RIG-I类受体(RIG-I,MDA5,LGP2),RNase L和OAS,在病毒感染期间已被报告与应激颗粒共定位。此外,最近的研究表明应激颗粒的功能可以超越免疫调节,比如通过抑制病毒复制。这些发现突显了应激颗粒作为细胞“缓冲区”的适应性角色,通过减轻有害的免疫应答和病毒复制来维持细胞稳态。因此,相分离在此表现为一种复杂的适应机制,协调着动态应答,包括检测外源分子以及在感染期间激活或缓冲先天免疫防御。
2 如何应对与GoPS和LoPS相关的疾病
正如前文所述,生物凝聚体的探索引起了基础科研和制药界的广泛关注。在当前治疗与相分离相关的疾病方法中,出现了两种主要策略,分别针对LLPS的“控制者”和“驱动者”。第一类,即控制者,主要包括结构蛋白质,如酶、细胞表面受体、核激素受体、离子通道和转运蛋白。这些蛋白质受到信号通路和多种PTM的调控。相比之下,相分离的驱动者包括特定的无序结构域蛋白质(IDPs)和核酸(DNA或RNA)。无论是蛋白质-蛋白质还是蛋白质-核酸的相互作用对于驱动LLPS都是不可或缺的。传统上,药物设计和表征在很大程度上依赖于潜在蛋白靶点的结构。药物蛋白质组的分析显示了很高的结构覆盖率,超过94%的靶点具有已解析的结构。在相分离的背景下,控制者通常采用“支架-客体”模式进行化学计量调节。受各种化学修饰的影响,支架蛋白质容易表现出不同物理化学性质,其中相分离随着凝聚物的溶解而消失,反之亦然。已知的累积例子有:(i) TDP-43的仿磷酸突变导致的相分离受损,RNA剪接活性降低(LoPS),以及FUS的丝氨酸磷酸化和精氨酸甲基化导致相分离减弱(LoPS); (ii) FMRP和CAPRIN1的磷酸化促进了它们的共相分离。
值得注意的是,在针对生物系统中异常相分离的通用药物筛选和开发平台方面,目前还是一片蓝海。在一项最近的研究中,研究人员聚焦于由融合基因引起的异常相分离,揭示了它们获取的相分离结域(PSs)和DNA结合结域(DBDs)与肿瘤发生过程密切相关。面对这一挑战,作者巧妙地设计了一个通用的高通量药物筛选平台,名为DropScan。利用这个平台,他们进行了广泛的筛选和多维分析相分离数据,最终发现LY2835219是一种新型且高度特异的化合物,可调节PS-DBD融合基因的异常相分离并调节癌相关基因的表达。这项研究具有双重目的,一方面揭示了PS-DBD融合基因在癌症发生中的重要性,更重要的是引入了一种通用且具有突破性的药物筛选平台。这个创新平台可以根据个体异常相分离疾病靶点的独特特征进行定制。值得注意的是,该平台有望解决复杂靶点(如神经退行性疾病、转录因子、核受体和其他需要创新和生理相关药物筛选平台的靶点)所带来的挑战。
DropScan的一个显著优势在于它能够利用目标分子自身的独特病理学特征和状态,准确识别传统方法可能忽略的药物候选物。这一竞争优势有望显著加速传统药物开发过程,并有可能重塑解决复杂药物靶点的格局。此外,该平台在应用方面展现了令人印象深刻的多功能性。通过修改和重新配置其模块,它可以轻松转向各种药物类型的开发和筛选,包括PROTAC、分子胶水、核酸类药物等。总体来看,DropScan在其通用性、可扩展性、适应性、通量和精度方面,都展现了较好的药物开发价值和潜力。
3 总结
凝聚体,曾经是一个相对长期以来未被发现的生物学现象,如今已经在制药行业引起了重大关注。例如Dewpoint Therapeutics作为行业领军者,还有一些初创公司如Nereid Therapeutics、Transition Bio、Eternbio、Medusa Therapeutics、Nuage Therapeutics、Granule Therapeutics和NuPhase Therapeutics。这些公司正在利用小分子操纵与疾病相关的无膜凝聚体。除此之外,一些较为成熟的制药巨头如Roche、Pfizer、Merck、Bayer、Insilito Medicine和Novo Nordisk也正在与这些初创公司或学术机构合作,探索凝聚体在药物发现和开发中的潜力。Dewpoint Therapeutics以生命科学为根基,专注于使用小分子的高通量筛选和体外药理学来溶解与疾病相关的凝聚体或直接阻止其形成。另一方面,Nereid Therapeutics以生物物理为中心的方法热衷于开发一系列工具,包括光遗传学平台和仿生系统,以了解主导液态组装和物质状态转变的物理化学机制。然而,值得注意的是,出于治疗目的操纵瞬时组装或其组成可能需要对凝聚体生物学有更深入的了解。我们距离对无膜细胞器的复杂生物学有一个完整的理解仍然很远,凝聚体生物学不仅是一个新兴领域,还促使对细胞生物学的重新思考。
在这篇综述中,研究人员努力提供了对异常相分离与疾病之间关联的最新进展以及潜在治疗策略探讨的全面总结。实际上,相分离现象的普遍存在强调了它们在细胞功能中的关键作用。在过去的十年里,该领域的研究人员已经利用各种实验技术,无论是在细胞内还是在细胞外的背景下,并整合了来自不同学科的知识,已然卓有成效地推动了我们对生物相分离的理解。一些活跃在技术创新端的科学家们已经开发了一些新兴的方法和策略,通过操控相分离来加速早期药物发现(Xu et al, 2021; Li et al,2022; Wang et al, 2023)。展望未来,该领域正在积极考虑引发进一步发展并着手迎接新的发现和迭代创新技术的阶段。随着制药行业越来越关注通过相分离的视角来解决疾病问题,有望在对抗癌症、神经退行性疾病和传染病等疾病方面取得重要进展。
第一批吃螃蟹的制药公司已经在积极探索这个领域,研发特异性靶向参与疾病过程的相分离组分的小分子药物。回顾人类漫长的制药长河,从第一个被批准上市的药物到当前,过往的药物研发过程中,科学家们利用物理,化学,生物等多交叉领域的关键技术大大提升药物研发的成功率。如果把这份厚重的长卷翻到首次提出药代动力学的时刻,首次提出药理学的时刻,首次提出大分子抗体药物研发的时刻,首次提出利用基因编辑治疗疾病的时刻……彼时彼刻,是否恰如此时此刻?一项新的科学技术真正的走向“To C端”(客户端)的完整周期常常会遵循这样一个客观规律:首次发现—无人问津—一片红海—存量竞争—实事求是, 科学发展,那么请问各位读者思考一下我们当前又处于哪一个阶段呢?实际上,无论是在科学发现端,还是社会应用层面,都需要“少数人”做最艰难且勇敢的先手决定,“多数人”去做果敢且坚定的拓荒者,正如世上本没有路,走的人多了自然就成了“道路”。时不我待,相信在未来的一段时间内,相分离生物学一定会提升我们对人类疾病与健康更高维度的理解,助力药物研发在更多疾病领域和方向实现突破。
NuPhase Therapeutics丁明瑞博士,许伟凡博士与清华大学裴高峰博士为本文共同第一作者。清华大学李丕龙教授为本文通讯作者。
原文链接:https://doi.org/10.1093/procel/pwad057
本文转载自公众号“BioArt”
中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
原标题:《【科技前沿】Protein & Cell综述 | 透过相分离和相变镜头重新思考疾病与药物研发》

