【学术前沿】专家点评Cell Research | 功能性淀粉样蛋白纤维解聚酶(amyloidas…
点评 | 张宏(中国科学院生物物理研究所)、刘聪(中国科学院生物与化学交叉研究中心)、陈家明(浙江大学)
蛋白质纤维化最早在神经退行性病人中被发现,例如阿尔茨海默病、帕金森病等。这些蛋白质纤维通过交叉β片层堆积,形成致密而稳定的淀粉样蛋白纤维斑(amyloid plaque),引发神经细胞功能紊乱,导致病变。因此最初蛋白质纤维普遍被认为都具有细胞毒性和致病性,被称为“致病性淀粉样蛋白纤维”。随着研究的拓展,一类介导信号转导的非细胞毒性蛋白质纤维被发现,被命名为“功能性淀粉样蛋白纤维”。尽管体外实验证明功能性和致病性淀粉样蛋白纤维具有类似的生物物理结构特征,但在生物体内功能性蛋白纤维为什么不具有细胞毒性并没有被回答。
哺乳动物中最大的一类功能性蛋白质纤维家族是RHIM蛋白纤维家族。RHIM蛋白是一类含有RHIM结构域的蛋白质(包括RIP1、RIP3、ZBP1和TRIF),通过RHIH-RHIM相互作用形成蛋白纤维,参与程序性细胞坏死信号转导(necroptosis)。信号启始型RHIM蛋白(RIP1、ZBP1和TRIF)将信号传递给效应型RHIM蛋白RIP3,然后招募并激活下游的细胞坏死执行蛋白MLKL。在体内,即使RHIM蛋白形成纤维,如果细胞内缺失下游的MLKL或膜裂解被ESCRT复合体及时修复,细胞也会免于发生死亡,且RHIM蛋白纤维会逐渐消融。这说明RHIM蛋白纤维只服务于信号转导,本身没有细胞毒性,这也是功能性蛋白纤维区别于致病性蛋白纤维的根本特性。
尽管在体外,RHIM蛋白具备高效自组装成纤维的特性,但在体内,许多组织(例如高表达RIP3的肾脏和肠道)却不会出现自发的程序性细胞坏死。因此,在体内生理条件下RHIM蛋白纤维的自发形成是如何被抑制的,引人深思。
2023年8月14日,中国科学院分子细胞科学卓越创新中心(原生化细胞所)的孙丽明研究组在Cell Research在线发表题为 HSPA8 acts as an amyloidase to suppress necroptosis by inhibiting and reversing functional amyloid formation 的研究成果。该研究发现HSPA8特异性识别RHIM蛋白,抑制其形成蛋白纤维;更有趣的是,HSPA8具备蛋白纤维解聚酶(amyloidase)活性,能够将已经形成的RHIM蛋白纤维解聚成非激活形式的单体形式。在细胞和小鼠体内HSPA8通过抑制RHIM蛋白聚合和解聚RHIM蛋白纤维而抑制程序性细胞坏死。
 首先,研究人员通过全基因组siRNA筛选,发现HSPA8 (也称为Hsc70)可以抑制细胞自发激活程序性细胞坏死,且这一特性并不是其他热休克蛋白成员的共性。此外,研究人员排除了HSPA8依赖的CMA的参与(Chaperone-Mediated Autophagy,分子伴侣介导的自噬),猜测HSPA8 通过独特的机制调控程序性细胞坏死。
首先,研究人员通过全基因组siRNA筛选,发现HSPA8 (也称为Hsc70)可以抑制细胞自发激活程序性细胞坏死,且这一特性并不是其他热休克蛋白成员的共性。此外,研究人员排除了HSPA8依赖的CMA的参与(Chaperone-Mediated Autophagy,分子伴侣介导的自噬),猜测HSPA8 通过独特的机制调控程序性细胞坏死。进一步研究发现,在小鼠体内抑制HSPA8的活性,能够直接诱发程序性细胞坏死介导的体温失衡和肠道损伤,且能加重小鼠的全身性炎症反应综合征(SIRS)反应。敲除Rip3或Mlkl能够挽救HSPA8功能缺失所造成的组织损伤。验证了HSPA8在体内靶向程序性细胞坏死的特异性。
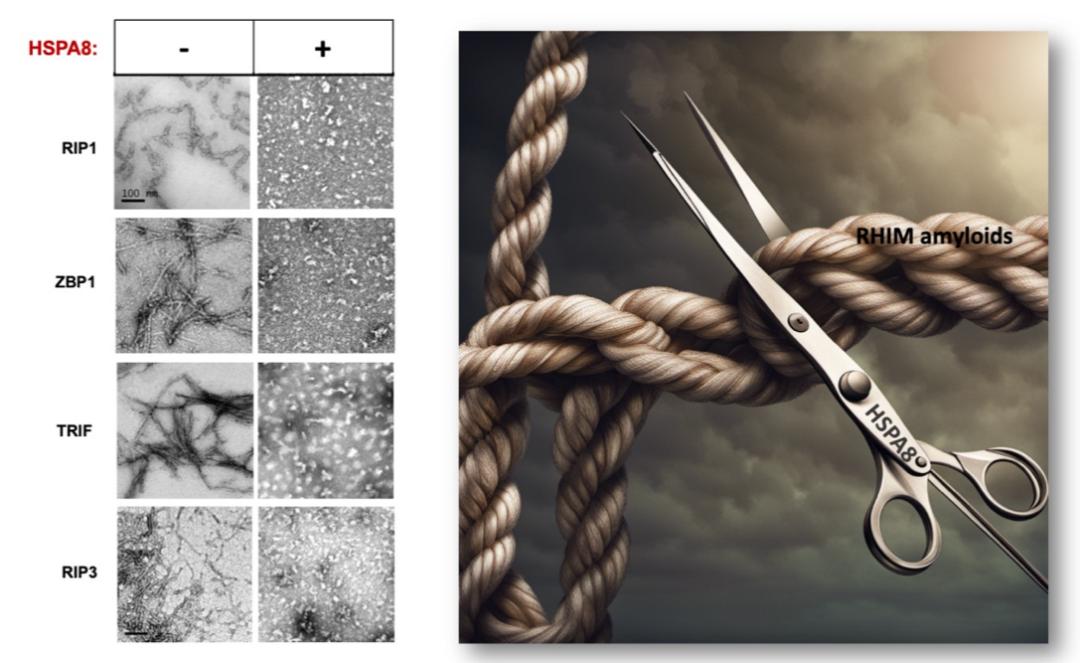 图1: HSPA8解聚RHIM蛋白纤维
图1: HSPA8解聚RHIM蛋白纤维通过一系列生物化学、分子生物学实验,研究人员发现HSPA8 的底物结合结构域 (SBD)能够特异性识别 RHIM 结构域中的疏水六肽基序—N (X 1 ) (X 3 ),并阐明了 HSPA8 靶向抑制RHIM蛋白纤维形成的分子机制:一方面 HSPA8 与RHIM蛋白单体结合,抑制 RHIM 结构域介导的寡聚化;另一方面通过水解ATP 供能,HSPA8 不依赖于其他分子伴侣,能够独立作为“蛋白纤维解聚酶—Amyloidase”解聚已聚合形成的 RHIM 蛋白纤维。通过上述机制,HSPA8逆转了细胞中多层次的RHIM蛋白纤维,既遏制了由RIP1、ZBP1和TRIF蛋白纤维介导的程序性细胞坏死的启始,又逆转了 RIP3蛋白纤维介导的坏死信号的放大,有效监控了自发性程序性细胞坏死在体内的发生。有趣的是,HSPA8不能识别也不能独立解聚致病性蛋白纤维,如a-Syn。
综上,这项工作报道了哺乳动物中的第一个蛋白纤维解聚酶amyloidase—HSPA8。HSPA8通过逆转RHIM蛋白纤维化,成为细胞内抑制程序性细胞坏死发生的关键检验点。HSPA8在体内不依赖于co-chaperone而独立解聚RHIM功能性蛋白纤维,从根本上支持了功能性蛋白纤维的可逆性特性,为区分疾病相关淀粉样蛋白纤维提供了直接依据。研究人员推测,细胞中多种功能性蛋白纤维可能对应多种潜在的蛋白纤维解聚酶,寻找新的纤维解聚酶将对于我们深入了解细胞稳态维持和信号传递的监控十分重要。该项研究也拓展了我们对非蛋白降解型负调控信号转导的认识,为开发针对程序性细胞坏死相关疾病的治疗新靶点提供了新的视角。
上海分子细胞科学卓越创新中心的孙丽明研究员为本文的通讯作者,博士研究生武二鹏、何文艳为本文的共同第一作者。该研究过程中得到了上海分子细胞科学卓越创新中心的汪胜研究员、上海科技大学陆珺霞研究员和王华翌研究员、复旦大学李继喜研究员等来自多家单位的专家们的大力协助。
专家点评
张宏(中国科学院生物物理研究所研究员)
毒性蛋白纤维在细胞中的异常累积与神经退行性疾病等多种人类疾病的发生发展密切关联。热休克分子伴侣、自噬等质量监控系统可以促使毒性蛋白纤维的解聚与清除,在细胞内稳态和机体健康的维持中发挥关键作用。细胞中也存在一类功能性的蛋白纤维结构,它们不具有细胞毒性,在生命活动的信号传递等过程中发挥重要功能,例如HET-s蛋白纤维介导了真菌异核不亲和性,哺乳动物的RHIM蛋白形成蛋白纤维激活程序性细胞坏死,人类的Pmel17蛋白纤维促进黑色素的沉积等。由于信号传导在体内具有时效性和可逆性,参与信号传递的蛋白纤维也应当在信号终止后迅速消融(降解或解聚)。因此,长期以来,研究者们猜测:相比于毒性蛋白纤维结构,功能性蛋白纤维可能具有动态可逆性,确保其不具有细胞毒性。但人们对功能性蛋白纤维维持高度动态可逆性的分子机制知之甚少。之前的报道发现细胞可以通过分子伴侣介导的自噬途径(CMA)降解RHIM蛋白。但细胞通过自噬清除蛋白聚集体是一个相对耗时的过程,无法满足信号快速终止的需求。RHIM蛋白具有很强的自激活特性,坏死信号能在短时间被快速激活,提示了细胞内可能存在其他更高效的实时监控RHIM聚集状态的机制。孙丽明团队的研究发现热休克蛋白HSPA8可以直接抑制RHIM蛋白纤维的组装,并通过解聚酶的活性快速将RHIM蛋白纤维逆转成单体。该研究为功能性蛋白纤维具有高度动态可逆性的猜测提供了有力证据和全新的分子调控机制。
HSPA8的经典功能包括识别包含KFERQ基序的底物,通过分子伴侣介导自噬(CMA)途径引导底物进入溶酶体降解。孙丽明团队的研究发现HSPA8可以特异性识别并结合一种新鉴定的蛋白基序— N (X 1 ) (X 3 ),以非经典、不依赖自噬途径的方式,抑制RHIM蛋白纤维的组装,并以ATP依赖的方式独立解聚已形成的RHIM蛋白纤维,具有典型的蛋白纤维解聚酶特征,是一个新的细胞坏死的关键监控点。值得注意的是,HSPA8独立的蛋白纤维解聚酶活性并不识别a-Syn等毒性蛋白纤维,表明功能性和毒性蛋白纤维具有不同的动态调控机制。该研究首次发现了HSPA8的蛋白纤维解聚酶特性,拓宽了对HSPA8底物和功能多样性的理解,也揭示了细胞差异性调控不同类型蛋白纤维结构的稳态及动态可逆性的分子机制。希望以该研究为起点,未来可以不断鉴定出更多潜在的调控不同功能性蛋白纤维动态可逆性的蛋白纤维解聚酶,发现更为深入的程序性细胞坏死等生命过程的调控分子机制,并发掘全新的相关疾病的治疗靶点。
专家点评
刘聪(中国科学院生物与化学交叉研究中心研究员)
蛋白淀粉样聚集不仅广泛存在于多种神经退行性疾病的病理过程中,还在生理过程中发挥着重要作用。哈佛大学的吴皓课题组早先发现,RIPK1与RIPK3能够形成淀粉样聚集体,介导细胞坏死(参考文献:PMID: 29681455;PMID: 22817896)。最近,厦门大学的韩家淮课题组通过超分辨成像技术证实了RIPK1与RIPK3在细胞坏死过程中,通过动态组装形成淀粉样聚集纤维构象(参考文献:PMID: 35256774)。孙丽明团队长期从事细胞程序性坏死分子机制及相关疾病机理的研究,在最新发表于Cell Research的研究中取得了重大突破,首次在哺乳动物细胞中鉴定出能够调控并解聚功能性淀粉样蛋白纤维的关键热休克蛋白HSPA8。该研究发现,HSPA8作为淀粉样蛋白纤维解聚酶(amyloidase),能够特异性识别含有RHIM基序的程序性坏死相关蛋白,抑制其淀粉样纤维的形成,并通过ATP水解提供能量解聚已经形成的淀粉样聚集,从而有效抑制坏死信号。
与典型的病理性淀粉样纤维不同,功能性淀粉样纤维在生物体内自然存在,并在多种生理过程中发挥关键作用,但对于功能性纤维聚集的调控以及其在生理过程中的作用机制尚知之甚少。鉴于淀粉样纤维的高度有序结构以及强大的复制和传播能力,为防止过度聚集引发病理,研究者们猜测细胞内应当存在相应的分子机制来调控功能性淀粉样纤维的聚集过程。孙丽明团队的研究发现功能性淀粉样蛋白纤维的解聚酶的存在,为细胞内调节功能性淀粉样纤维发挥生理作用提供了新的理解。具体而言,通过淀粉样蛋白酶特异性解聚RHIM蛋白聚集体,可以终止坏死信号传导和过度激活。这一发现还进一步暗示细胞内可能存在多种淀粉样蛋白解聚酶家族,通过抑制不同类型的功能性纤维来调控相应的生理过程。此外,细胞程序性坏死的激活与多种疾病有关,包括神经退行性疾病、炎症反应和癌症等。因此,本研究的概念性成果提供了一种抑制程序性坏死以减轻疾病病理的潜在治疗策略。
专家点评
陈家明(Francis Chan) (浙江大学特聘教授)
Cell Research – Reversing a deadly assembly
Signal adaptors that contain the “RIP Homotypic Interaction Motif” (RHIM) promote cell death by necroptosis through assembly of amyloid-like structures. In this articles, Liming Sun and colleagues from the Chinese Academy of Sciences and State Key Lab of Cell Biology reported that the chaperone HSPA8 functions as an amyloidase to dissolve RHIM-associated complexes. This discovery revealed a previously unknown regulatory step in necroptosis that may have implications in therapies targeting necroptosis.
It has been well established that Caspase 8 cleaves RIPK1 and RIPK3 to restrict necroptosis. Thus, pharmacologic or genetic inhibition of Caspase 8 is a common trick that scientists used to sensitize cells to necroptosis. The authors started out by asking whether there are other factors that similarly limit necroptosis. Through a genome-wide siRNA screen, the authors identified HSPA8 as another negative regulator of necroptosis.
Unlike Caspase 8 inhibition, HSPA8 appears to tune the sensitivity to necroptosis rather than acting as an “on-off” switch for necroptosis. For example, siRNA knockdown of HSPA8 increased classical TNF, SM and zVAD-induced necroptosis as well as necroptosis induced by chemical-induced dimerization of RIPK3. CoIP experiments with truncated RIPK3 and HSPA8 revealed that C-terminal substrate binding domain (SBD) of HSPA8 physically interacts with the RHIM of RIPK3. Interestingly, knockdown of HSPA8 increased the amount of RIPK3 polymers during necroptosis. Since the RHIM of RIPK3 was previously reported to form amyloid filaments during necroptosis, the authors asked if HSPA8 might regulate RIPK3 amyloid formation. Amyloid binding to the fluorescent dye thioflavin T (ThT) is a common method to measure the extent of amyloid complex formation. Using this in vitro RHIM amyloid polymerization assay, the authors showed that HSPA8 indeed could restrict amyloid-like polymerization of RIPK3. Moreover, HSPA8 could reduce ThT fluorescence in vitro, suggesting that it could reverse amyloid complex formation. Further evidence that indicates that HSPA8 might function as an “amyloidase” comes from the increased accessibility of the RIPK3 RHIM complex to trypsin digestion when coincubated with HSPA8. Hence, HSPA8 exerts its anti-necroptotic activity through two distinct mechanisms. On one hand, HSPA8 reverses amyloid formation in an ATP-dependent manner. On the other hand, HSPA8 binds to RHIM to prevent its amyloid-like polymerization.
The RHIM is defined by a highly conserved tetra-peptide core (V/I)Q(I/V/L)G flanked by predominantly hydrophobic residues. Structural simulation-guided mutagenesis revealed that HSPA8 binds to a motif defined as N(X1)φ(X3) C-terminal to RHIM tetrapeptide core, in which φ is a critical interacting hydrophobic residue (L, I or M). This motif is conserved in other RHIM-containing adaptors including RIPK1, TRIF and ZBP1. Indeed, HSPA8 also exhibits amyloidase activity towards the other RHIM adaptors.
Finally, the authors asked whether HSPA8 also regulates necroptosis in vivo. To this end, the authors used two HSPA8 inhibitors, Piftithrin-u (PES) and Apoptozole, to examine the in vivo role of HSPA8. The authors found that that both PES and Apoptozole induced hypothermia and extensive intestinal tissue damage marked by elevated pMLKL staining. Strikingly, these phenotypes were substantially alleviated in Ripk3-deficient mice, indicating that tissue toxicity induced by HSPA8 inhibition is due to necroptosis induction. In a second in vivo model, systemic inflammatory response syndrome (SIRS), which previous work showed to be a process mediated by RIPK3 and MLKL, was further exacerbated by PES and Apoptozole. These results indicate the amyloidase activity of HSPA8 likely also regulate necroptosis in pathophysiology.
The authors’ finding that amyloidal signaling complexes involving the RHIM adaptors can be reversed by HSPA8 changed the widely accepted view that amyloid complexes are stable and irreversible. The findings raise the tantalizing possibility that agonists that turn on HSPA8 activity can be an alternative to inhibition of RIP kinase activities in treating necroptosis-associated inflammation and diseases.
孙丽明实验室介绍:http://sun-lab.sibcb.ac.cn
欢迎加入!
原文链接:
https://doi.org/10.1038/s41422-023-00859-3
参考文献
1. Yakupova, E. I., Bobyleva, L. G., Shumeyko, S. A., Vikhlyantsev, I. M. & Bobylev, A. G. Amyloids: The History of Toxicity and Functionality. Biology (Basel) 10 (2021). https://doi.org:10.3390/biology10050394
2. Li, J. et al. The RIP1/RIP3 necrosome forms a functional amyloid signaling complex required for programmed necrosis. Cell 150, 339-350 (2012). https://doi.org:10.1016/j.cell.2012.06.019
3. Chen, X. et al. Mosaic composition of RIP1-RIP3 signalling hub and its role in regulating cell death. Nat Cell Biol (2022). https://doi.org:10.1038/s41556-022-00854-7
4. Gong, Y. N. et al. ESCRT-III Acts Downstream of MLKL to Regulate Necroptotic Cell Death and Its Consequences. Cell 169, 286-300 e216 (2017). https://doi.org:10.1016/j.cell.2017.03.020
5. Stricher, F., Macri, C., Ruff, M. & Muller, S. HSPA8/HSC70 chaperone protein: structure, function, and chemical targeting. Autophagy 9, 1937-1954 (2013). https://doi.org:10.4161/auto.26448
原标题:《【学术前沿】专家点评Cell Research | 功能性淀粉样蛋白纤维解聚酶(amyloidase)抑制程序性细胞坏死》

