Nature子刊:周子健/陈小元/郭伟圣团队实现T细胞免疫活性的在体可视化调控
虽然免疫治疗策略在抗肿瘤研究中取得了令人鼓舞的成绩,但是由于免疫系统的复杂性以及肿瘤微环境的异质性,免疫治疗在临床肿瘤患者中的综合响应率仍然较低(不足30%)。
基于免疫激活策略的肿瘤治疗效果很大程度上依赖于免疫T细胞在肿瘤中的杀伤活性。然而,肿瘤中浸润的T细胞可能受到肿瘤微环境的影响,导致其降低或丧失活性(包括增殖和免疫活性等),这一现象被称为“T细胞耗竭”。由于T细胞存在“耗竭”现象,通过传统方法认为的肿瘤中效应T细胞的数量,可能无法准确反映其免疫活性。
因此,对于肿瘤中T细胞在体免疫活性的探索对于肿瘤治疗调控和预后评价具有重要意义。目前,针对T细胞活性的在体成像策略主要包括以下几种:直接细胞标记、抗体结合靶向、对受体或细胞因子等的标记和报告基因策略。然而,这些针对T细胞的活体成像方法主要是基于细胞特异性标志物的生物结合靶向策略,主要反映的是T细胞的数量和受体分布,难以准确揭示T细胞的免疫活性。
2022年12月19日,厦门大学公共卫生学院周子健研究员与新加坡国立大学陈小元教授和广州医科大学郭伟圣教授合作,在 Nature 子刊 Nature Nanotechnology 上发表了题为:Targeting the activity of T cells by membrane surface redox regulation for cancer theranostics 的研究论文。
该研究针对T细胞在活性氧微环境中发生免疫活性耗竭的关键科学问题,首次利用化学生物学手段靶向捕获T细胞膜表面活性氧,实现了T细胞免疫活性的在体可视化调控。

针对活性氧环境中T细胞衰竭而失去免疫活性的关键科学问题,研究团队构建了一种T细胞靶向的膜融合脂质体——T-Fulips。它与T细胞靶向膜融合后,将一种经典的活性氧捕获剂2,2,6,6-四甲基哌啶(TEMP)分子展示到T细胞的表面,捕获T细胞膜表面的活性氧,从而提升T细胞在活性氧环境中的免疫活性。同时,TEMP分子本身由逆磁性被氧化为顺磁性的TEMPO,激活磁共振成像,实现了T细胞免疫活性的可视化调控。
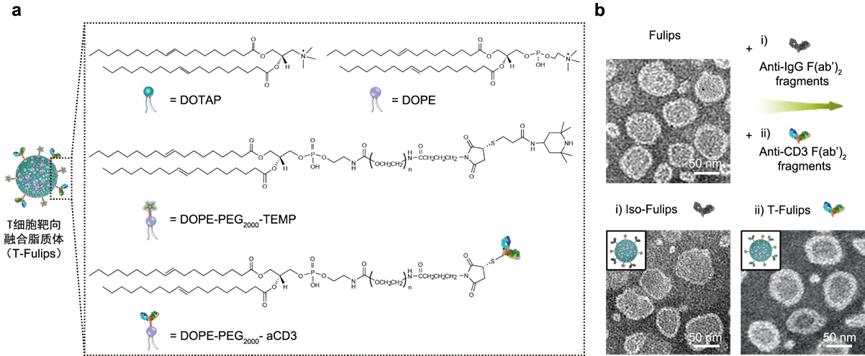
图1:(a)T-Fulips组分及结构示意图;(b)T-Fulips及同型对照Iso-Fulips透射电镜图
在这项研究中,T细胞膜上的TEMP基团可充当活性氧“诱饵”,使T细胞免受氧化引起的表面自由-SH基团变为S-S基团,反之,-SH基团被氧化降低T细胞的活性。与此同时,逆磁性TEMP基团向顺磁性的TEMPO自由基转变,使纵向弛豫时间(T1)以“0”到“1”的方式发生显著变化,可用于磁共振成像(MRI)对于T细胞的免疫活性的定性和定量评价(图2a)。磁共振成像是一种非侵入、无辐射、穿透深度不受限制的医学影像诊断技术,在临床诊疗研究中发挥着不可或缺的作用。不同于放射性核素的分子标记成像方法(Always ON),磁共振成像可以基于造影剂探针的磁性调控和功能设计实现响应激活(开关)、信号放大和多模式的成像,特别是在具有生物化学活性小分子的造影成像方面有独特的优势。近年来,磁共振分子影像在肿瘤等疾病的诊疗研究中显示出了独特的科学价值和应用前景。周子健团队在磁共振分子影像探针的基础理论、合成制备和诊疗应用方面具有丰富而且特色的研究工作基础。
在小鼠肿瘤放疗(RT)模型中,靶向T细胞的融合脂质体T-Fulips显示出比对照组(Iso-Fulips)更高的T细胞活化率和肿瘤抑制率。更重要的是,TEMPO展现出的纵向弛豫时间T1的变化,实现了T细胞活性及放疗疗效的早期预测(图2b、c)。
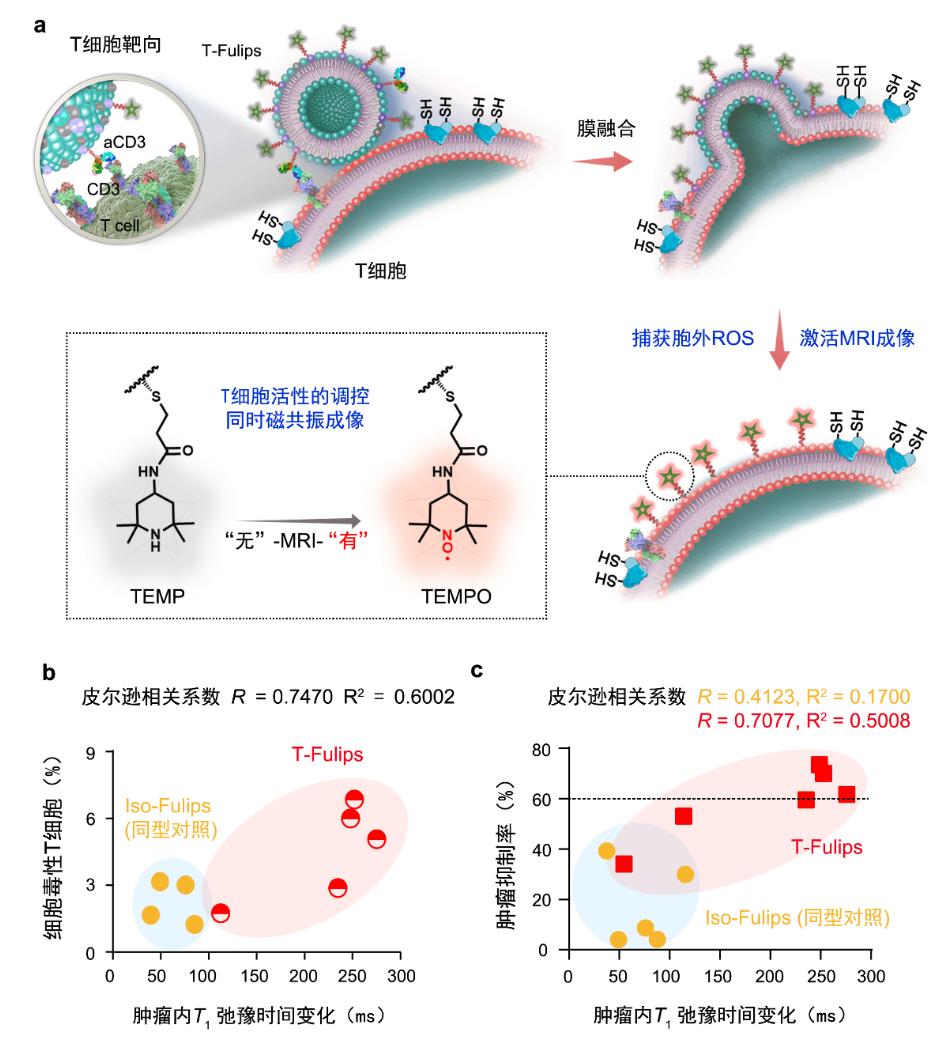
图2:(a)本研究的设计思路示意图;(b)治疗后肿瘤内MRI信号变化与细胞毒性T细胞含量的相关性分析结果;(c)治疗后肿瘤内MRI信号变化与肿瘤抑制率的相关性分析结果
该研究使用化学靶向策略来调控并量化 T 细胞在肿瘤治疗中的原位活性,解析了炎症活性氧反应对浸润T细胞免疫活性影响的动态过程,为肿瘤治疗的免疫响应调控和影像预后评价研究提供了新思路。
该工作主要提到的是效应T细胞,但是通过化学生物学手段靶向氧化还原代谢可能同样适用于其它免疫细胞的调控,如B细胞、树突状细胞、自然杀伤细胞、巨噬细胞和中性粒细胞等。更重要的是,针对免疫细胞的功能和活性可能有望为其它免疫激活相关疾病的诊疗研究提供新思路,如病毒感染(如COVID-19)、慢性炎症性疾病和类风湿性关节炎等。审稿人也对这项工作的原创性和转化前景给与了肯定性的评价。
厦门大学博士后石昌荣、硕士生张倩玉为该论文的共同第一作者,厦门大学周子健老师、新加坡国立大学陈小元教授和广州医科大学郭伟圣教授为该论文的共同通讯作者。
论文链接:
https://www.nature.com/articles/s41565-022-01261-7

