专家点评|寒冷激活棕色脂肪抑制肿瘤生长,这是一个全新理念
·前期人们普遍认为肿瘤生长受到微环境的重要影响,但较少关注器官间通过整体代谢的相互作用,及这一作用对肿瘤的影响。
·该工作首次发现,冷暴露促进棕色脂肪组织葡萄糖摄取,并抑制肿瘤细胞的葡萄糖摄取,进而抑制其生长。
为了适应自身能量需求,肿瘤表现出独特的代谢特征,可通过有氧糖酵解的形式产生ATP,为细胞活动供能。相比线粒体呼吸,有氧糖酵解的效率大大降低。因此,肿瘤细胞会从机体中摄取大量的葡萄糖,为其生长、侵袭和转移提供能量【1,2】。
棕色脂肪组织是哺乳动物中对维持体温起重要作用的特异性产热组织,其高表达解偶联蛋白1(UCP1)。当受到寒冷刺激或药物干预时,成年人体内的棕色脂肪组织可被激活。受交感神经信号控制,棕色脂肪细胞可通过UCP1,将氧化传递呼吸链中的电子传递过程与ATP的生成解偶联,从而将线粒体跨膜质子梯度转化为热能释放,这一过程被称为非颤抖性生热(Non-shivering thermogenesis, NST)。与肿瘤细胞类似,棕色脂肪细胞会迅速高效地利用葡萄糖等营养物质,作为产热的关键代谢底物【3, 4】。基于这一机制,棕色脂肪激活及产热已成为调节血糖,治疗肥胖、Ⅱ型糖尿病等代谢性疾病的潜在疗法,并在临床研究中取得一定进展。但在其他重大疾病领域,棕色脂肪的治疗潜力仍尚待探索。值得一提的是,棕色脂肪和肿瘤均具有大量摄取葡萄糖的共同点,但学界对于棕色脂肪组织及其和肿瘤的关系仍知之甚少。
2022年8月3日,瑞典卡罗林斯卡医学院Yihai Cao院士课题组与复旦大学、山东大学、温州医科大学等高校的科研人员合作,在《自然》杂志上发表了题为Brown-fat-mediated tumour suppression by cold-altered global metabolism的研究成果,提出了寒冷通过激活棕色脂肪抑制肿瘤生长的全新理念,并给出了相应的治疗思路。

研究者们首先通过构建小鼠结直肠癌、胰腺癌、黑色素瘤等多种移植瘤模型、以及结直肠癌自发成瘤模型、乳腺癌自发成瘤模型等不同实体瘤模型,应用不同温度干预,发现与热中性的30℃处理组相比,4℃冷暴露显著抑制小鼠肿瘤生长,并延长荷瘤小鼠生存期。通过使用核心体温仍为37℃的非体表肿瘤模型,研究者们排除了寒冷对体表肿瘤的直接影响,并发现肿瘤内部的微血管密度下降,细胞凋亡增加。
研究者们进一步观察到,在寒冷暴露下,小鼠的棕色脂肪显著激活。PET-CT结果显示,冷暴露显著促进荷瘤小鼠棕色脂肪的葡萄糖摄取,相反明显抑制肿瘤的葡萄糖摄取。更进一步,棕色脂肪移除术可有效逆转寒冷抑制肿瘤生长的现象。基因富集分析及代谢组分析均显示:冷暴露导致棕色脂肪组织葡萄糖代谢显著上调。而肿瘤组织葡萄糖代谢则被显著抑制,且其中的PI3K及mTOR信号均下调。
该研究结果说明寒冷激活棕色脂肪组织,通过血糖竞争机制,从降低葡萄糖的来源及削弱肿瘤摄取葡萄糖能力两方面有效抑制肿瘤生长。研究者们随后使用了高糖饲养荷瘤小鼠模型,及Ucp1基因敲除荷瘤小鼠模型验证了这一机制。
最后,研究者们小规模招募了健康志愿者及肿瘤患者,进行了前瞻性的临床观察。结果证明,健康志愿者和肿瘤患者具有足量的棕色脂肪并可被寒冷激活。与此同时,肿瘤患者接受一周的温和的冷暴露治疗后,体内棕色脂肪组织显著激活并增加葡萄糖摄取,相反,患者的肿瘤组织中葡萄糖摄取降低,提示了应用寒冷干预治疗肿瘤的临床可行性。
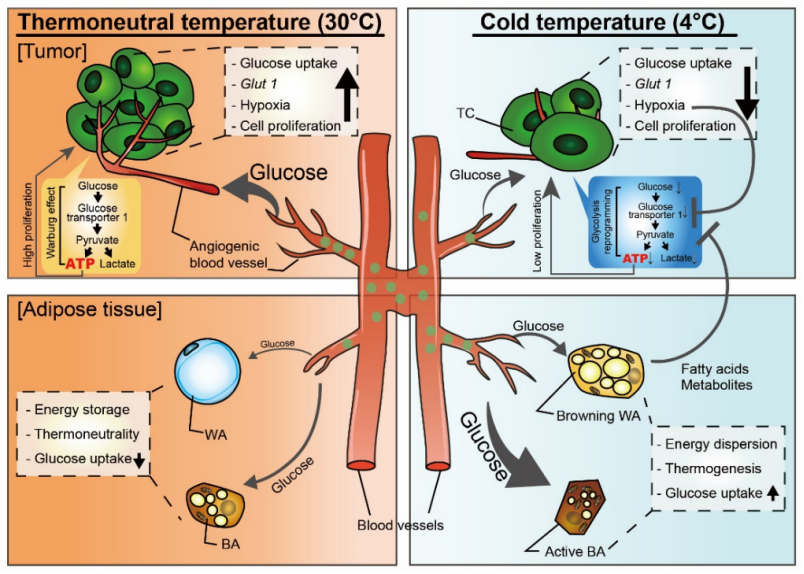
(图说:在热中性温度下,癌细胞主要通过糖酵解获得能量,肿瘤中的血管生成提供足够的葡萄糖供肿瘤消耗。而脂肪细胞保持惰性。在寒冷环境下,棕色脂肪组织等明显增加了葡萄糖的摄取和生热作用,而肿瘤的葡萄糖摄取量明显减少。)
综上所述,该工作首次发现,冷暴露促进棕色脂肪组织葡萄糖摄取,并抑制肿瘤细胞的葡萄糖摄取,进而抑制其生长。这一发现巩固了糖代谢在肿瘤发展中的重要作用,揭示了冷暴露对于肿瘤组织的影响及其潜在机制,并提出了抗肿瘤的“寒冷疗法”。
中国工程院外籍院士、瑞典卡罗林斯卡医学院Yihai Cao教授为该工作的通讯作者。瑞典卡罗林斯卡医学院的Takahiro Seki博士和复旦大学基础医学院细胞与遗传医学系杨云龙研究员为本文共同第一作者。
专家点评
李校堃(中国工程院院士,温州医科大学)
Yihai Cao院士及其合作者提出了寒冷通过激活棕色脂肪抑制肿瘤生长的新理念,并探索了冷暴露对肿瘤治疗的潜在临床意义。该研究发现在多种实体瘤模型中,寒冷均可有效抑制肿瘤生长。冷刺激下,肿瘤组织糖代谢被显著抑制,与之对应的是棕色脂肪组织葡萄糖代谢显著提高。该研究结果证实寒冷激活棕色脂肪组织,通过血糖竞争机制有效抑制肿瘤生长,包括临床恶性程度极高的胰腺癌等难治肿瘤。而且,抑制效果可能不亚于抗癌药物的疗效,提示了寒冷作为生理性疗法的潜力。
肿瘤治疗的难点在于每一种治疗方案都有它的局限性,目前放射、手术和药物治疗等手段均在恶性肿瘤防治中未能取得理想治疗效果。前期人们普遍认为肿瘤生长受到微环境的重要影响,但较少关注器官间通过整体代谢的相互作用,及这一作用对肿瘤的影响。该研究创造性的将研究重点聚焦在机体整体代谢与肿瘤局部代谢的相互调节,为肿瘤防治的研究提供了全新的里程碑式的探索思路。
该成果提出了棕色脂肪通过整体代谢调节肿瘤生长的里程碑式创新理念,具有很强的临床转化应用价值,未来可设计开展临床试验,通过冷暴露或者药物激活棕色脂肪的方法抑制肿瘤。
专家点评
Tiffany Horng(上海科技大学,教授)
Despite multiple therapies available (most of which incur significant side-effects), cancer remains one of the leading causes of death worldwide. In a new study published in Nature, Cao and colleagues report that cold-activated BAT outcompetes tumors for glucose to restrict tumor growth, suggesting cold exposure as a new approach in cancer therapy. (癌症是世界主要死亡原因之一,尽管已有多种治疗手段,但大多数会产生明显的副作用。在《自然》杂志上发表的一项新研究中,Cao及合作者报告,冷暴露激活的棕色脂肪能与肿瘤竞争葡萄糖,从而限制肿瘤生长,提示寒冷干预是癌症治疗的一种新方法。)
Using multiple cancer cell types and tumor grafts as well as spontaneous tumor models, the authors first showed that cold exposure limits tumor growth compared to thermoneutral housing, leading to enhanced survival of tumor-bearing mice. While cold exposure reduced tumor cell proliferation and hypoxia in the tumor microenvironment, these effects were not due to the direct ability of cold exposure to limit tumor cell proliferation and growth. Rather, the authors used an elegant and compelling set of experiments to show that cold exposure activates BAT to outcompete tumors for glucose. PET imaging analysis indicated that in cold-exposed mice, glucose uptake was concentrated in BAT rather than tumors, which was associated with reduced tumor GLUTs expression, glycolysis and PI3K-AKT signaling. Supporting a critical role for the BAT in the effects of cold exposure, surgical removal of BAT abrogated its tumor suppressive effects. UCP1, a key regulator of BAT thermogenic ability, was also important, since engraftment of tumors into UCP1 KO mice mitigated the effects of cold exposure. Importantly, dietary supplementation of glucose increased tumor glucose utilization and tumor growth in cold-exposed mice, strongly suggesting that glucose competition between BAT and the tumor as an underpinning basis of the tumor suppressive effects of cold exposure.(研究者采用多种类型的移植瘤模型及自发肿瘤模型研究发现,与热中性条件相比,冷暴露限制了肿瘤生长,延长荷瘤小鼠生存期。虽然冷暴露减少了肿瘤细胞的增殖和肿瘤微环境的缺氧,但这并非由于冷暴露直接限制肿瘤细胞增殖。相反,通过一系列优雅的、令人信服的实验,研究者表明,冷暴露激活了棕色脂肪,使其在葡萄糖摄取上超过肿瘤。PET成像表明,在冷暴露的小鼠中,葡萄糖摄取集中在棕色脂肪中而非肿瘤中,这与肿瘤GLUTs的表达、糖酵解和PI3K-AKT信号的减少有关。棕色脂肪移除后寒冷抑制肿瘤的作用被废除,说明棕色脂肪在其中的关键作用。基因敲除棕色脂肪产热的关键蛋白UCP1也可减轻冷暴露的影响。重要的是,在冷暴露的小鼠中,补充喂食葡萄糖回补了肿瘤的葡萄糖摄取和肿瘤生长,这强烈表明棕色脂肪和肿瘤之间的葡萄糖竞争是冷暴露抑瘤作用的基础。)
Finally, in a pilot human study, the authors found that tolerable cold exposure in a Hodgkin’s lymphoma patient increased PET activity in BAT while reducing such activity in the lymphoma.(最后,在一项临床初步研究中,作者发现霍奇金淋巴瘤患者经可耐受的冷暴露后,增加了棕色脂肪的PET活性,同时减少了淋巴瘤的这种活性。)
Altogether, this is an exciting study that uncovers cold exposure as a new approach to fighting cancer that should be safe and easy to implement, and may be broadly applicable to many cancer types.(总而言之,这是一项令人兴奋的研究,它发现冷暴露是一种安全的、易实施的抗癌新方法,并可能广泛适用于多种癌症类型。)
(原题为《专家点评Nature | 寒冷抑制实体瘤生长的机制——寒冷通过激活棕色脂肪抑制肿瘤生长的全新理念》)
原文链接:
https://www.nature.com/articles/s41586-022-05030-3
参考资料
1. Vander Heiden, M. G., Cantley, L. C. & Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science 324, 1029–1033 (2009).
2. Gatenby, R. A. & Gillies, R. J. Why do cancers have high aerobic glycolysis. Nat. Rev. Cancer 4, 891–899 (2004).
3. Cannon, B. & Nedergaard, J. Brown adipose tissue: function and physiological significance. Physiol. Rev. 84, 277–359 (2004).
4. Seaton, T. B., Welle, S. & Campbell, R. G. Thermogenesis in brown adipose tissue. N. Engl. J. Med. 312, 1062–1063 (1985).
