Nature重大突破:张毅团队破解染色体外环状DNA三大谜团
作为生命的遗传物质,DNA可分为线性和环状两种。真核生物基因组染色体DNA以线性方式存在,而细胞器(线粒体和叶绿体)、绝大多数细菌、部分病毒基因组DNA则以环状形式存在。
染色体之外环状DNA(eccDNA,extrachromosomal circular DNA)指在真核生物中发现的,染色体外的、非线粒体、非叶绿体环状结构DNA。eccDNA的发现(1964)甚至早于广泛熟知的线粒体DNA和细菌质粒DNA,两者分别于1966年和 1967年被显微镜观察证实为环状。
历经多半个世纪的研究,人们对eccDNA与基因组DNA的序列高度同源,已经达成共识,但因其尺寸差异巨大:从数百bp到数百kb不等,研究人员据此提出了多种命名,microDNA主要指400bp以内的环状DNA,ecDNA(extrachromosomal DNA)被用以描述在癌细胞中发现的、尺寸数百kb以上的染色体外DNA,其巨大尺寸,足以容纳全长基因和DNA复制起始位点,因此能自主复制和扩增,并与癌基因的扩增和癌症的发生有关。 而eccDNA被用来指比ecDNA小的所有染色体外环状DNA,这些eccDNA几乎存在于所有的真核细胞系和组织器官中,与染色体DNA相比较,其丰度极低,含量易变。
迄今为止,关于eccDNA三大基本问题仍然没有答案:
1,eccDNA与基因组的序列同源性是否具备特异性(从哪来)?
2,eccDNA的产生机制是什么(怎么来)?
3,eccDNA有无生物学功能(做什么)?
2021年10月20日,美国哈佛医学院、波士顿儿童医院张毅教授实验室在 Nature 期刊在线发表了题为:eccDNAs are apoptotic products with high innate immunostimulatory activity 的研究,对上述三个基本问题做出了回答。

张毅教授实验室在表观遗传在胚胎早期发育的调控作用,做了大量杰出的工作。早期胚胎发育过程中,基因组中大量的转座子、逆转座子会被激活。这些激活的转座子及逆转座子可能会再插入,破坏基因组稳定性。因此胚胎如何避免活性转座子、逆转座子对基因组的破坏,是一个重要的科学问题。其中一个合理的假说是:激活后转座子和逆转座子最终以eccDNA方式存在,而避免了重新插入破坏基因组。为了验证这一假说,张毅教授实验室五年前开始对eccDNA展开研究。
有效地分离和纯化研究对象,是取得研究进展的先决条件。eccDNA在生物样本中丰度极低而其环状结构又极易受损,双链上任意位点的断裂均会将环状变成线性,而导致其丢失。有效的分离纯化一直是eccDNA 研究的一大难题。
传统的eccDNA分离纯化方法主要分为两步:1、碱性裂解复性粗提环状DNA;2、核酸外切酶选择性消化线性DNA。然而,文章作者发现,传统的eccDNA纯化方法远不能有效分离到满意纯度的环状DNA, eccDNA样品中60-80%的分子仍然呈线性,这与近10年来的研究报道中的结果一致。作者推测,天然生物样本中的DNA,可能存在多种修饰和复杂结构,如氧化(oxidation)、交联(cross-link),DNA复制叉、十字结(Cruciform)、脱氧鸟嘌呤四联体(G-quadruplex)等。这些复杂结构,极可能抑制了核酸外切酶的作用,使单依靠核酸外切酶消化、得到纯环状DNA,变得不可能。
鉴于此,研究人员在优化传统的碱性粗提环状DNA和核酸外切酶消化线性DNA的基础上,增加了一个纯化步骤:从核酸外切酶消化产物中选择性回收环状DNA。新的方法实现了eccDNA样品在显微镜镜检时,95%以上的DNA分子呈环状(图1)。与此同时,新方法还有耗时短、稳定性高的特点:将传统耗时一周的分离纯化过程压缩到一天内完成;对平行样品、批次样品间的eccDNA纯化,表现出很好的平行性和高可再现性。
为了得到每一个eccDNA分子环的准确序列信息,研究人员还将滚环扩增(rolling cycle amplification)和第三代的纳米孔测序技术(Oxford Nanopore)结合(图1),实现了仅用三代测序获取eccDNA的全长序列。
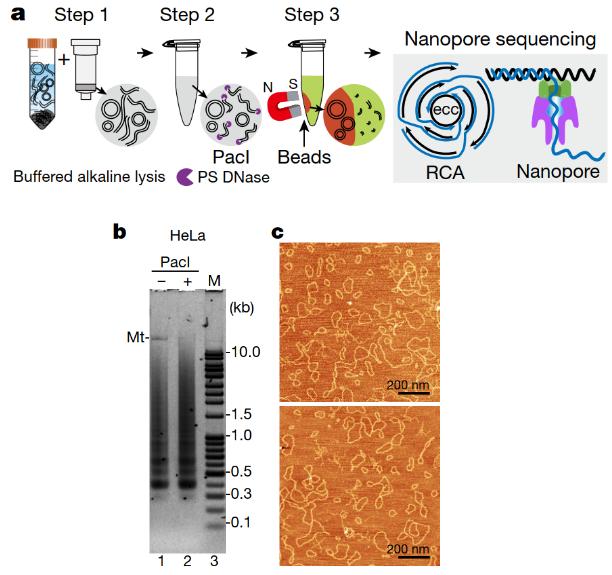
图1,(a) 新的环状DNA的纯化和测序方法;(b) eccDNA琼脂糖凝胶电泳图;(c)eccDNA分子的原子力显微镜镜检图。
为了避免普通细胞系基因组中可能存在的突变、重组、结构紊乱等因素对其eccDNA与参考基因组DNA(reference genome)序列同源比对分析的影响,作者选择从基因组相对稳定的小鼠胚胎干细胞系中提取eccDNA进行研究,获取了160多万个eccDNA分子的全长序列信息及基因组来源位置信息。分析发现,eccDNA随机来源于基因组片段,包括单片段自环化和多片段连接环化,大小集中在200bp到3kb之间,分布近似于寡聚核小体(oligo-nucleosome)间的尺寸分布规律。这些结果预示eccDNA可能是基因组DNA随机断裂产生片段的环化产物。
细胞凋亡是广泛发生于真核生物体内、和体外培养细胞中的程序性细胞死亡,其中一个重要特征就是细胞凋亡过程中,特定的核酸酶会在核小体的间区切断基因组DNA,形成寡聚核小体大小规律分布的线性片段化DNA(ladder-like)。因此作者比较了正常培养细胞和诱导凋亡的细胞中的eccDNA含量,发现凋亡细胞中的eccDNA量明显增加,说明凋亡能诱导eccDNA的发生。
为了弄清eccDNA的产生是否源于片段化的DNA,作者鉴定并敲除了小鼠干细胞中负责凋亡DNA片段化的核酸酶DNase1l3,得到了凋亡DNA片段化缺陷的细胞株(DNase1l3 KO),DNase1l3的敲除并不影响细胞凋亡导致的细胞死亡,但其凋亡寡聚核小体样的DNA片段化的现象则完全丧失,相应的是,DNase1l3 KO细胞系也失去了凋亡诱导的eccDNA发生的能力(图2);这说明eccDNA发生源于凋亡产生的DNA片段。
线性DNA片段的环化离不开DNA连接酶(DNA ligase),真核生物共有三个DNA连接酶基因:Lig1,Lig3和Lig4。通过建立DNA连接酶的单基因敲除和多基因敲除细胞系。研究人员发现,Lig1和Lig4的缺失完全不妨碍eccDNA的生成,而Lig3缺失的细胞系中的eccDNA产量则急剧降低,说明Lig3是最主要的负责DNA环化的连接酶(图2)。这回答了eccDNA是怎么发生的问题。

图2,(a-b)凋亡DNA片段化缺失细胞(DNase1l3 KO)不能产生eccDNA;(c)Lig3的缺失抑制了eccDNA的产生。
随后,研究人员挑战了eccDNA的第三大基本问题:eccDNA是否有功能?
鉴于eccDNA在序列上没有表现出明显的特征,作者首先排除基于序列来探索eccDNA的整体生物学功能的可能。文章作者通过检阅文献发现,先天免疫(innate immunity)过程中的重要蛋白,如HMGB1,TLR9等对DNA的弯折(curvature,bending)结构表现出了更高的亲和力,因此推测,所有eccDNA分子的共性——环状结构或许在先天免疫反应中有特殊作用。
随后的研究证实了这一推测:eccDNA的环状特性赋予其超强的刺激先天免疫反应的能力。在典型的免疫细胞——树突细胞(BMDC,bone marrow derived dendritic cells)和巨噬细胞(BMDM,bone marrow derived macrophages)中,相比于同大小的线性基因组DNA片段, eccDNA能诱导出更高的细胞因子(图3)(Ⅰ型干扰素(IFN-α,β), 白介素6(IL-6), 肿瘤坏死因子(TNF-α)等)的表达,显示出超强的刺激免疫反应的能力。当eccDNA分子环被单位点切断成对应的线性分子后,即失去了刺激免疫反应的超强能力(图3),证实了eccDNA的强效免疫刺激能力依赖于其环状结构。为了进一步排除eccDNA序列及潜在的转录对免疫刺激影响,作者用与eccDNA相似大小、但序列为随机生成的、人工合成环状DNA处理免疫细胞,不出预料,人工合成的DNA环完美再现了纯化的天然eccDNA对免疫细胞的超强刺激能力(图3)。深入研究显示,eccDNA的超强先天免疫刺激能力依赖于胞内Sting信号途径而非Myd88信号途径。
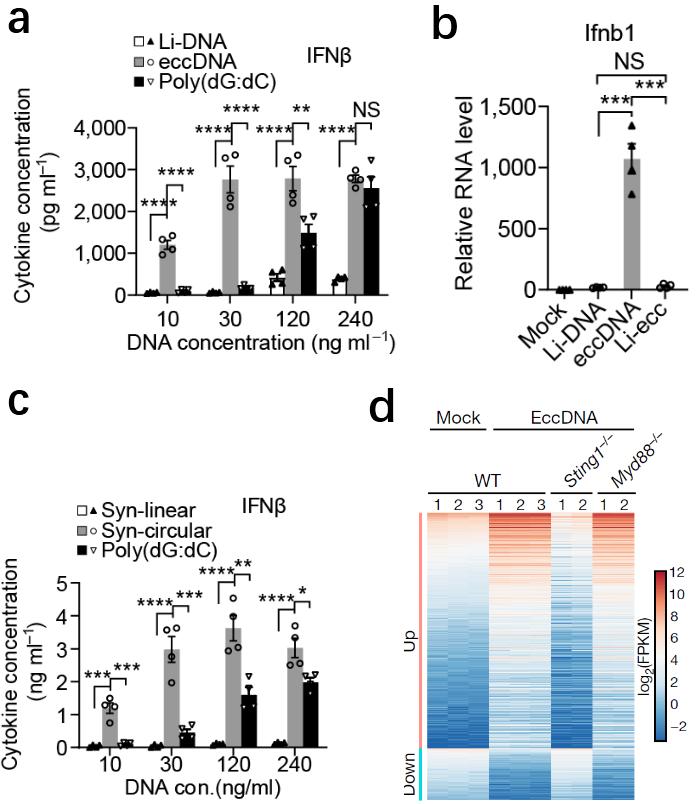
图3,(a)eccDNA具有超强的诱导干扰素IFN-β表达的能力(d)eccDNA被线性化(Li-DNA)后失去诱导干扰素IFN-β表达的能力;(c)人工合成的随机序列DNA环具有超强的诱导干扰素IFN-β表达的能力;(d)eccDNA对免疫的刺激依赖于Sting信号途径而非Myd88信号途径。
总之,该研究就长达半个多世纪的eccDNA谜题,在三个最基本的方向上给出了清晰的答案:
1,eccDNA随机来源于染色体基因组DNA,没有明显的位置或序列的特异性(从哪来);
2,eccDNA是Lig3介导的凋亡DNA片段的环化产物(怎么来);
3,eccDNA具有超强的刺激先天免疫反应的能力(能做什么)。
该研究对细胞凋亡和先天免疫两大领域具有深远的影响,特别是对短时间内产生大量细胞死亡的多种疾病、或疾病治疗过程,如细菌、病毒的急性致命传染病、癌症的免疫治疗等。此外,该研究也对核酸疫苗和疫苗佐剂的设计提供了新的设计思路和路径。
张毅教授为本文的通讯作者,王元高博士为本文的第一作者。王萌博士、Mohamed Nadhir Djekidel博士、陈欢博士、刘迪博士和Frederick Alt教授亦对本研究做出重要贡献。该研究中,原子力显微镜的使用得到了Wyss研究所的Yin Peng教授的倾情相助。
论文链接:
https://www.nature.com/articles/s41586-021-04009-w

