钙离子内流加重内质网应激——神经退行性疾病新帮凶
原创 图图 神经现实 收录于话题#神经前研 | NeuroHub132个

文献:Chanaday, Natali L., et al. "Presynaptic store-operated Ca2+ entry drives excitatory spontaneous neurotransmission and augments endoplasmic reticulum stress." Neuron (2021).
DOI:https://doi.org/10.1016/j.neuron.2021.02.023
导读作者:图图 | 封面:Maggie Chiang
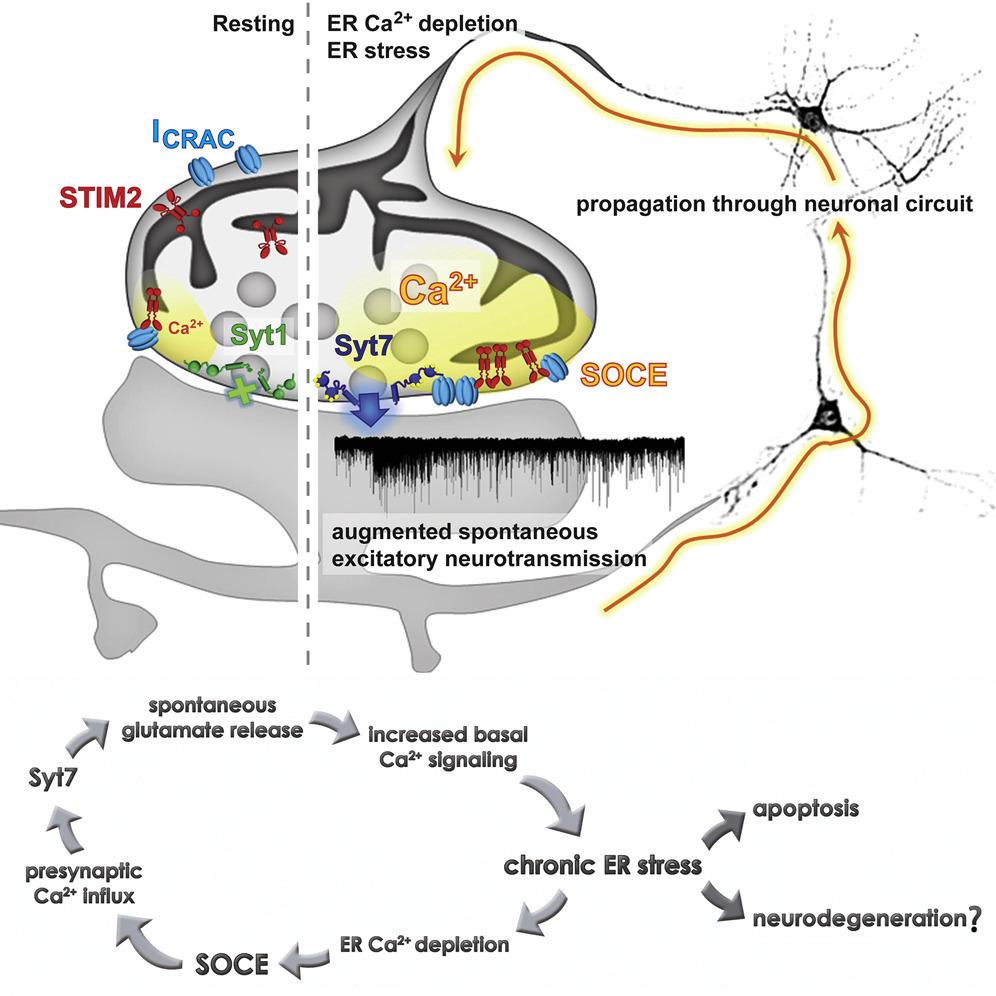
我们熟知的细胞器-内质网(endoplasmic reticulum,ER),在神经元中广泛分布,包括树突和轴突,他们对轴突的形成、成熟以及可塑性至关重要。然而突触前内质网对神经递质释放的作用,却仍然掩藏在神秘的面纱之下。钙离子内源储存量介导的钙离子内流(Store-operated calcium entry,SOCE)可以被大量减少内质网内腔的钙离子激活,转而触发钙离子流入细胞质,然后通过sarco-ER Ca2+-ATPase(SERCA)这种ATP酶将Ca2+补充回ER。
之前的研究表明,这个过程的发生与Ca2+感受器-基质相互作用分子(stromal interaction molecule,STIM)有关,STIM亚型1(STIM1)可以调节经典的SOCE的过程,而STIM2因其较低的Ca2+亲和力,可感知更为细微的Ca2+浓度的变化,起到精细调节的作用。STIM2更多分布在海马体中,并通过重要的钙离子/钙调素依赖的蛋白激酶或钙调蛋白激酶(Ca2+/calmodulin-dependent protein kinases)通路参与树突的发生、成熟和稳定等过程。然而我们并不清楚,SOCE到底有没有可能发生在海马体突触前端?如果有,他的作用是什么?又是通过何种分子机制实现他的功能的呢?
最近,来自范德堡大学的Kavalali实验室发现,突触前端的SOCE过程与ER压力有关,SOCE可以通过STIM2促进由syt7介导的神经递质的释放,从而加强兴奋性神经突触的自发神经传递。Kavalali团队首先通过加入/耗尽ER Ca2+的方法研究ER Ca2+含量的变化对突触囊泡本身的释放所带来的影响。他们观察到,缺少胞外Ca2+(0mM Ca2+)会大大减少兴奋性突触mEPSC的频率,相反如果加入毒胡萝卜素(thapsigargin,TG),也就是可以耗尽ER Ca2+从而激发SOCE,则会引起非常明显的mEPSC频率上升,尽管诱发概率(evoked probability)并没有任何改变。而这种TG带来的“救援”行动却受限于兴奋性突触,对抑制性神经传递爱莫能助。
接着,科研团队确定了STIM2在ER、神经元胞体、突触前突起(presynaptic boutons)和树突棘(dendritic spines)等位置的分布,并进一步确认STIM2大量存在于兴奋性突触前末端,说明SOCE很有可能也发生于突触中。接着,他们敲除或下调STIM2表达,注意到之前由TG诱发的mEPSC频率增加现象并没有发生,说明STIM2对兴奋性神经突触的自发神经传递的促进必不可少。
更进一步,研究团队发现瞬时消耗ER Ca2+确实可以上调突触前Ca2+的总体水平,而阻止SOCE则可避免由ER Ca2+引发的Ca2+的总体水平上调。如果破坏7型突触结合素(synaptotagmin-7,syt7)则可以阻断SOCE调控的mEPSC频率增加,证明了ER Ca2+的细微变化可以诱发突触前SOCE,增加胞质内Ca2+,从而被syt7感知并引起更多的兴奋性突触的自发谷氨酸释放。因为之前在多种神经退行性疾病中都发现了内质网应激(Endoplasmic Reticulum stress),很有可能突触前SOCE过程也暗搓搓地为这些疾病贡献了一份自己的黑暗力量。
- Chanaday et al., Neuron -
研究员们发现,如果长时间(48h)用药物诱发慢性ER应激,会显著提高mEPSC频率。而同种药物处理并没有在syt7KO神经元或注入SOCE抑制剂的神经元中掀起太大的波澜。所以这个结果证明了长时程扰乱ER Ca2+会引起慢性ER应激,这种慢性压力联合起SOCE引发持续的突触前Ca2+含量增高,加强syt7介导的神经递质自释放,而这种长期的自释放增加会导致严重的突触功能紊乱和细胞凋亡。
总的来说,这篇研究揭示了一个由内质网钙离子调控的神经递质释放新机制,为神经退行性疾病的治疗提供了新的可能性。
原标题:《钙离子内流加重内质网应激——神经退行性疾病新帮凶》

