如何识别和处理恶性结直肠息肉?最新共识给出这些建议
原创 陈晨 医学界消化肝病频道 收录于话题#指南速递10个
*本文所涉及专业部分,仅供医学专业人士阅读参考

一文掌握最新USMSTF共识要点!
恶性结直肠息肉指肿瘤侵及黏膜下层但未达固有肌层的病变,TMN分期pT1,也称黏膜下层浸润性病变。黏膜下层的肿瘤浸润可能导致淋巴血管转移,结直肠息肉的癌变率约0.2%-5%。
如何通过内镜下特征,判断息肉应直接交给外科手术还是予以内镜切除?内镜切除后结合病理结果,应继续内镜监测还是追加外科手术?这些都是临床上需要处理的关键问题。美国结直肠癌多学会工作组(USMSTF)于今年11月,发布了恶性结直肠息肉的内镜识别和管理策略建议,对以上几个问题做了解答。
重点内容抢先看!
该建议围绕6个关键问题,提出以下中心观点:内镜下发现结直肠息肉伴深层黏膜下浸润(黏膜下浸润深度≥1mm),应直接提交外科手术;当发现浅层黏膜下浸润(深度<1mm)风险增加时,应予以最佳的内镜切除技术和标本处理;当发现内镜下切除的息肉有黏膜下浸润时,应权衡外科手术的风险和益处。
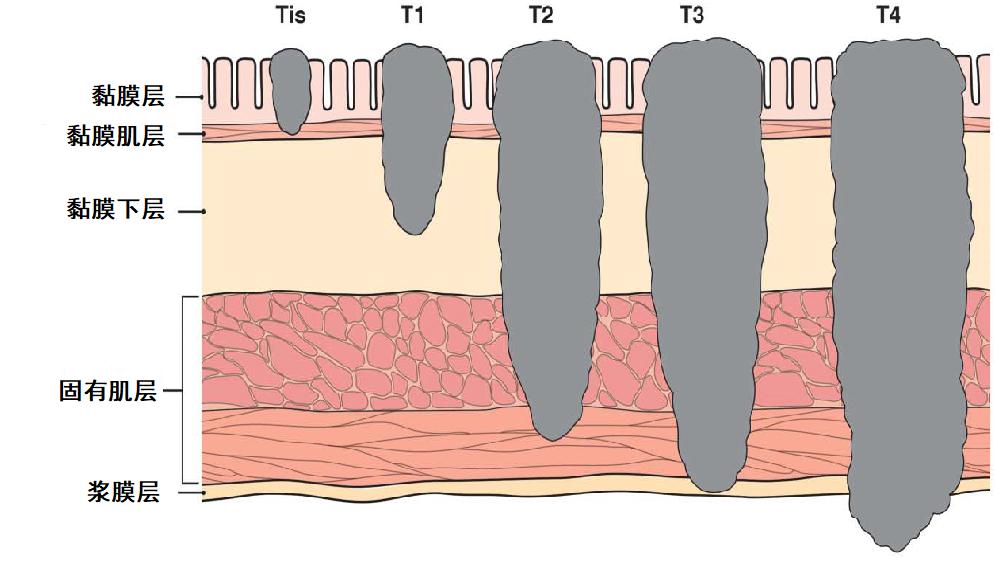
图1:美国癌症联合委员会(AJCC)癌症浸润深度分类
本文总结了USMSTF共识要点,并结合我国结直肠癌诊疗规范(2020 年版),供临床医师参考。
以下为文中所用的内镜及组织学分类:
1、内镜下表面形态分型
表1:NICE分型(可无放大)
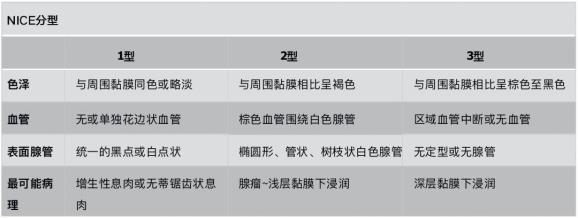
表2:JENT分型(将NICE 2型分为2a和2b)
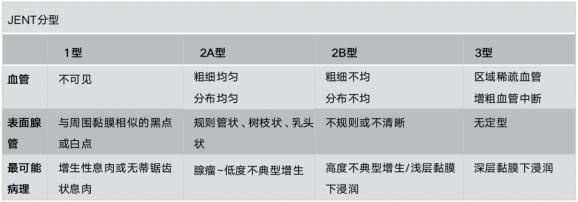
表3:Kudo工藤pit pattern分型(需染色、放大)
2、内镜下形态学分型
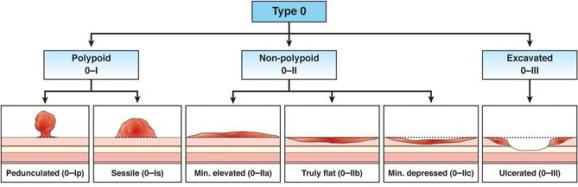
图2:巴黎分型
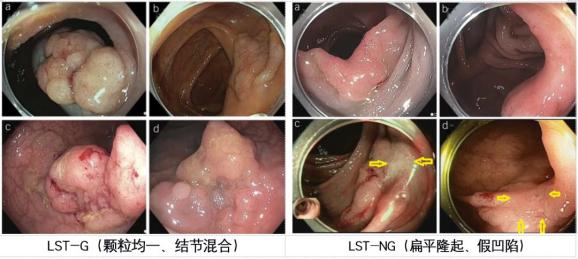
图3:侧向发育性肿瘤
3、浸润深度组织学分类
完整的黏膜下层在内镜切除标本中不典型,因此,用光学显微镜下测量黏膜下浸润深度的方法替代。浸润深度<1mm为浅层黏膜下浸润,≥1mm为深层黏膜下浸润。
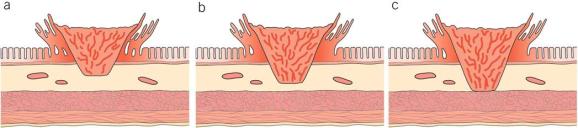
图4:Kikuchi和Kitajima分类(适用于无蒂)
一般内镜下在息肉蒂部切断,限制了Haggitt分类对于切除息肉的评估。
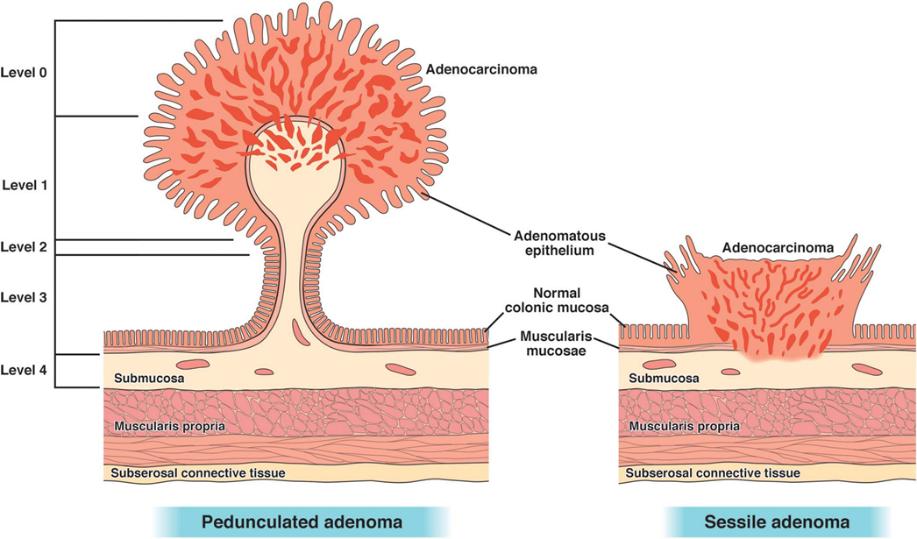
图5:黏膜下浸润深度的Haggitt分类(多适用于有蒂)
最新USMSTF共识:六问六答
Q:
问题1a:结直肠息肉的哪些内镜特征可以预测癌细胞深层黏膜下浸润?
A:
推荐1a:具有NICE 3型或Kudo V型(VN或VI)特征的有蒂及无蒂息肉考虑有深层黏膜下浸润(强推荐,高质量证据)。
Q:
问题1b:当怀疑有深层黏膜下浸润的时候,应如何处理无蒂及有蒂息肉?
A:
推荐1b:具有NICE 3型或Kudo V型(VN或VI)特征的无蒂息肉应活检(在表面形态破坏处),穿刺活检(除非在盲肠及其附近),并移交外科手术。有以上特征的有蒂息肉应内镜下切除(弱推荐,低质量证据)。
■ 讨论
无蒂病变(0-Is和0-II)
深层黏膜下浸润的特征具有高度特异性,研究表明NICE分型中的3个主要指标(色泽、血管、腺管形态)中的任何一种都有94%的准确率和96%的阴性预测值。
同样,Kudo VN型表明深层黏膜下浸润。澳大利亚一项前瞻性、多中心研究评估了479例≥20mm息肉患者,V型pit患者56%浸润至深层黏膜下层,而其他类型仅为4%-5%。
无蒂息肉的抬举征阴性也与深层黏膜下浸润有关,阳性预测值约为80%。但既往活检、烧灼或穿刺活检引起的黏膜下纤维化,也可能导致抬举征阴性。
有蒂病变(0-Ip)
有蒂息肉若有深层黏膜下浸润的特征,仍是内镜下切除的适应证。因为整体的组织学特征可能仍然是有利的。有蒂息肉应经蒂整块切除,准确的病理诊断是分期和治疗的关键。
Q:
问题2a:在无蒂息肉中,哪些内镜特征可以预测浅层黏膜下浸润?
A:
推荐意见2a:无蒂或伴凹陷的LST-NG或者伴明显结节的LST-G,提示有较高的黏膜下浸润风险(弱推荐,中等质量证据)。
Q:
问题2b:对于伴有浅层黏膜下浸润的无蒂及有蒂息肉,最佳的内镜切除方法是什么?
A:
推荐意见2b:基于当地的技术能力,在可行的情况下,建议对此类病变内镜下整块切除而非分块切除。在伴明显结节的LST-G病变中,至少结节区域应当整块切除。所有有蒂息肉,即使很大也应整块切除(弱推荐、低质量证据)。
■ 讨论
伴凹陷(0-IIc)的息肉,即使较小大多也和黏膜下浸润有关。研究指出0-IIc成分对黏膜下浸润有较高的特异性(95.9%)和诊断准确率(90.3%),但敏感性较低(21%)。结合巴黎分型和大体形态学,能够提高对隐匿性黏膜下浸润(缺乏黏膜下浸润的内镜表现,如凹陷或溃疡;或者表面pit形态破坏)的预测。JENT 2B型病变有较高的浅层黏膜下浸润风险,应当考虑整块切除。JENT分型在无放大内镜的情况下的准确性尚不明确。
病变大小或位置本身都没有足够的价值来可靠地预测黏膜下浸润风险,但结合其他内镜下特征,这些因素值得纳入考量。多项研究表明,≥20mm的病变黏膜下浸润的风险更高。
颗粒均一型LST-G倾向于生长至较大直径,但无论大小,其发生黏膜下浸润风险都非常低(<2%)。而结节混合型LST-G具有较高的黏膜下浸润风险(>20mm病变38%)。LST-NG更多见于右半结肠,黏膜下浸润的风险很高(20-29mm假凹陷型41.4%,扁平隆起型10.4%)。
直肠壁相比于结肠壁更厚,部分直肠位于腹膜反折下方,切除相对更安全。此外,直肠恶性息肉切除后随访发现需要手术的比例高于结肠,浅层黏膜下浸润的风险更高,因此更支持整块切除。
综上,在缺乏深层黏膜下浸润内镜特征的情况下,与浅层浸润风险有关的内镜特征包括LST-NG(尤其是有凹陷形态),有显著结节的LST-G。若这类病变整块切除后,标本妥善处理,则可准确评估黏膜下浸润深度。由于浅层黏膜下浸润内镜切除后肠壁或淋巴结残留的风险较低,整块切除后可避免外科手术,若分块切除后可能需外科手术。对于有显著结节的较大LST-G,通常将结节整块切除,其余部分分块切除。内镜黏膜下剥离术(ESD)可获得更高的整块切除率,但也有更高的风险,因此内镜下切除的实际方法应合理考虑病变大小、形态、位置,以及当地专家水平和资源条件。
Q:
问题3:有黏膜下浸润特征的息肉整块切除后应当如何处理后送检病理?
A:
推荐意见3:建议以优化标本定位和病理评估的方式处理(弱推荐,低质量证据)。
■ 讨论
带蒂息肉整块切除后不应切开后取出。病理检查时,应过息肉头部和蒂部对半切开,有利于评估癌症浸润位置。如蒂部收缩迅速,在放入福尔马林之前在蒂部插入固定针。
考虑有黏膜下浸润的无蒂病变,整块切除后,周围用不锈钢针固定于坚硬表面,以免组织收缩和卷曲,影响病理定位和切片。通常间隔2mm垂直于切除平面进行切片。标本定位不佳可能导致病理检查难以找到侧切缘和垂直切缘,从而导致对浸润深度的测量和对边缘受累的评估不准确。
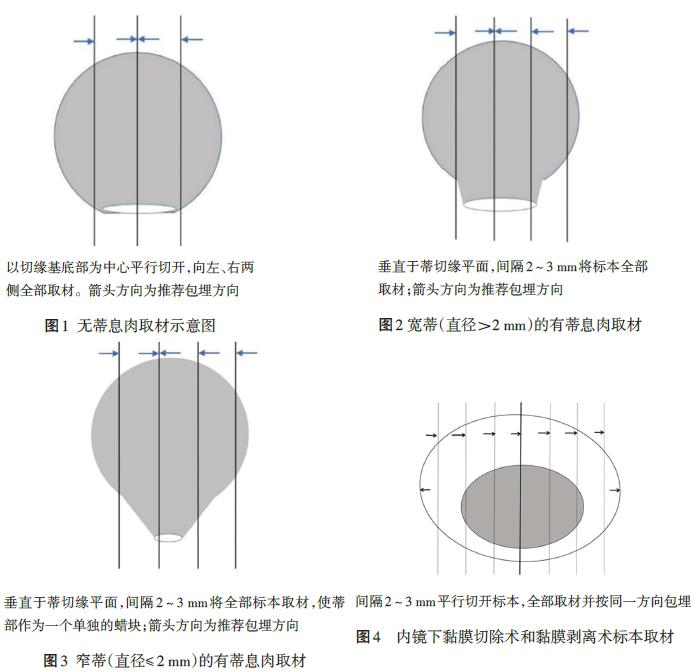
图6:内镜下切除标本取材
Q:
问题4a:无蒂恶性息肉的哪些组织学特征与淋巴结转移相关,从而增加局部或区域复发的风险?
A:
推荐4a:建议以优化标本定位和病理评估的方式处理有黏膜下浸润风险的整块切除标本(弱推荐,低质量证据)。
Q:
问题4b:有蒂恶性息肉的哪些组织学特征与淋巴结转移相关,从而增加局部或区域复发的风险?
A:
推荐4b:有蒂恶性息肉若有以下特征之一(肿瘤分化差、淋巴血管浸润、切除边缘距肿瘤1mm以内),则有较高的残留或复发风险(强推荐,中等质量证据)。
■ 讨论
息肉切除后的组织学特征对预测淋巴结转移(LNM)及局部、区域或远处转移的结直肠癌有价值。美国国家综合癌症网络(NCCN)推荐以下4个特征为LNM高风险且需外科手术:切除边缘阳性(<1mm或不确定),组织学等级3或4,淋巴血管浸润,肿瘤出芽(tumor budding)。对于无蒂息肉,浸润深度与之最为相关,而对于有蒂息肉,切缘非常重要。
黏膜下浸润深度:对于无蒂恶性息肉来说,浸润深度≥1mm(光学测微计测量)被认为是黏膜下深层浸润和LNM风险增加的界值。一项系统回顾发现≥SM2或浸润深度≥1mm者LNM风险上升(OR3.00)。
息肉的切缘:中国结直肠癌诊疗规范(2020 年版)认为有蒂病变分为两种情况,当黏膜肌层呈分支状生长时,以两侧肿瘤和非肿瘤交界点之间的连线为基线,基线以上的浸润视为头浸润,是内镜治疗的适应证;基线以下的浸润视为蒂浸润,相当于黏膜下层深层浸润,结合其他因素考虑外科手术;当有蒂病变的黏膜肌层可以定位或不是呈分支状生长时,按扁平病变测量浸润深度。
USMSTF考虑到有蒂息肉常经蒂部横切,无法很好地参考Haggitt分型,应主要参考切缘情况。对于有蒂和无蒂恶性息肉,肿瘤与切缘的距离是LNM和复发的重要组织学危险因素。对于切缘距离≥1mm的恶性息肉,局部复发或LNM的比例是0%-2%,而<1mm(定义切缘阳性)并在内镜术后追加外科手术者为21%-33%。
肿瘤分化程度:低分化肿瘤的LNM风险比中高分化的肿瘤更高。Meta分析显示低分化是LNM的危险因素(OR8.27)。
淋巴血管浸润:内镜切除标本中淋巴血管浸润是LNM的独立危险因素。Choi等人对8项研究进行系统回顾,发现伴淋巴血管浸润的患者LNM风险增加(OR 5.47)。
肿瘤出芽:肿瘤出芽是指在息肉的侵袭边缘局灶孤立的癌细胞或者一簇<5个的癌细胞。一般以热点区数量为准。目前对于其界值尚无统一定论。Meta分析显示肿瘤出芽是LNM的独立危险因素(OR 4.59)。最近,肿瘤出芽国际共识(ITBCC)发布推荐意见,包括:肿瘤出芽定义是指散在的单个肿瘤细胞或 ≤ 4个肿瘤细胞的细胞簇;肿瘤出芽是恶性息肉LNM的独立预测因素,且应结合其他临床病理特征进行多学科评估,并作为CRC报告系统的一部分。
上述讨论的组织学因素都与恶性息肉内镜术后残留的高风险相关,是追加外科手术的指征,但需要结合患者的手术风险和合并症。此外,任何分块切除的有蒂或无蒂息肉,或无法在病理评价时正确定位并评估的有蒂息肉,均为外科手术指征。
Q:
问题5:恶性结直肠息肉病理报告的标准是什么?
A:
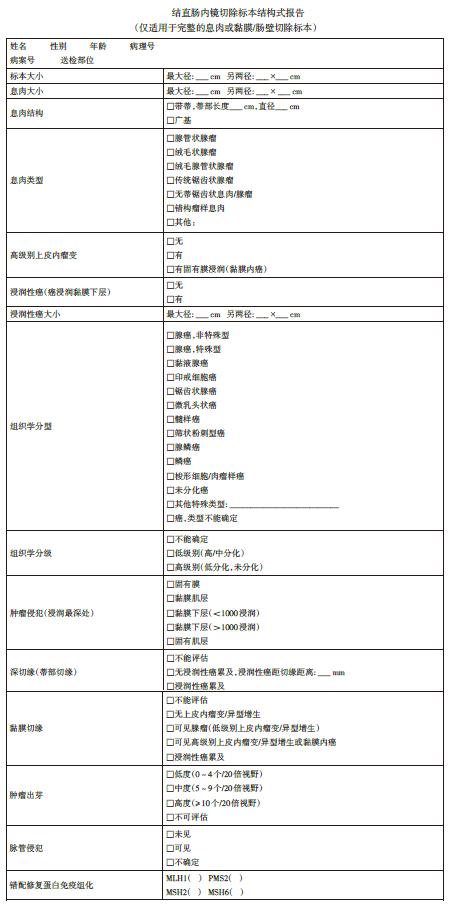
推荐5:建议遵循美国病理学家学会(CAP)的结构化模板,报告应包括组织学类型、分化程度、肿瘤扩散/浸润、有无蒂和黏膜边缘情况、是否存在淋巴血管浸润。建议也包括标本完整性、息肉大小、息肉形态、肿瘤出芽(弱推荐,低质量证据)。
■ 讨论
息肉切除后的组织学特征对预测淋巴结转移(LNM)及局部、区域或远处转移的CRC有价值。美国国家综合癌症网络(NCCN)指南推荐以下4个特征为LNM高风险且需外科手术:切除边缘阳性(<1mm或不确定),组织学等级3或4,淋巴血管浸润,肿瘤出芽(tumor budding)。对于无蒂息肉,浸润深度与之最为相关,而对于有蒂息肉,切缘非常重要。
良好的病理报告有助于提高息肉切除术后决策质量。报告应列出肿瘤位置,病理医师应报告标本完整性,以便准确评估切缘。还需报告息肉大小和形态(有蒂、无蒂)。
组织学亚型按照世界卫生组织(WHO)结直肠癌分型。使用4级评分系统报告分化程度:高分化、中分化、低分化、未分化。浸润性成分的大小应与肿瘤的最大范围一起报告。测量黏膜下浸润深度,尤其无蒂息肉。报告浸润性癌与垂直切缘的距离,有无淋巴血管浸润,若有肿瘤出芽应予报告。
表4:结直肠内镜切除标本结构式报告(我国)
Q:
问题6:哪些人应当参与恶性息肉的多学科治疗?
A:
推荐6:建立胃肠病学、病理学、肿瘤学、外科学医师及患者之间的沟通方案,共同决策恶性息肉的治疗(弱推荐,低质量证据)。
■ 讨论
恶性息肉在诊断、评估、提供治疗方案过程中有诸多步骤,所以最好有多学科合作。根据患者因素(年龄、伴随疾病、患者偏好)和息肉特征(大小、组织学)进行个体化决策。结肠癌手术的总体死亡率约1%-8%,且与患者年龄和伴随疾病有关。恶性息肉的治疗目标是减少过度或不足的手术,同时降低复发和转移的几率。
总之,治疗恶性息肉的最佳方案始于全面的内镜评估,旨在识别深层黏膜下浸润特征。对有深层黏膜下浸润的无蒂息肉,内镜下活检后外科手术切除;有较高浅层浸润风险的病变,应考虑内镜下整块切除并予以恰当的标本处理;当病理报告内镜完全切除的病灶中有癌症浸润时,是否行外科手术应基于是否整块切除和充分的病理学评估、是否有不良组织学成分、患者手术风险和死亡率以及患者偏好。
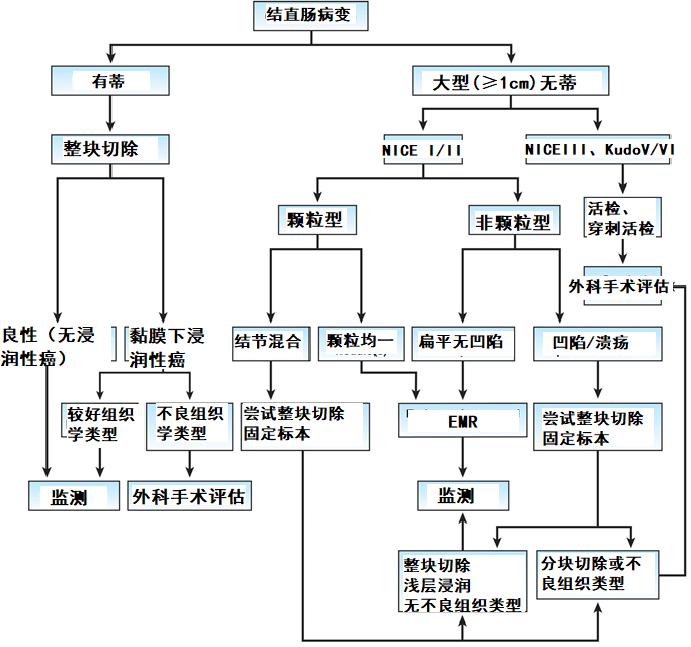
图7:恶性息肉评估和管理流程
参考文献:
[1]Shaukat A, Kaltenbach T, Dominitz J A, et al. Endoscopic Recognition and Management Strategies for Malignant Colorectal Polyps: Recommendations of the US Multi-Society Task Force on Colorectal Cancer[J]. Am J Gastroenterol,2020,115(11):1751-1767.
[2]中华人民共和国国家卫生健康委员会医政医管局,中华医学会肿瘤学分会.中国结直肠癌诊疗规范(2020年版)[J]. 中国实用外科杂志,2020,40(6):601-625.
本文来源:医学界消化肝病频道
本文作者:陈晨
原标题:《如何识别和处理恶性结直肠息肉?最新共识给出这些建议》

