从免疫受体到免疫疗法:他在基础研究中理解生命健康与疾病
【编者按】在上海市科学技术委员会资助(项目编号:22DZ2304300)下,澎湃新闻联合《世界科学》对获得国家及上海市科技奖励的成果进行科普化报道。
本篇报道围绕2022年上海市自然科学奖一等奖项目“获得性免疫反应的触发机制研究”展开,该奖项由中国科学院分子细胞科学卓越创新中心许琛琦研究员领衔获得。
“现在已经到了免疫治疗的时代。”
2024年2月6日,中国科学院分子细胞卓越创新中心研究员许琛琦回忆,2009年他刚回国时, PD-1(Programmed cell Death protein-1,程序性细胞死亡蛋白-1)不那么为人知晓和关注。现在,PD-1已被发展为肿瘤一线疗法。
他领衔的“获得性免疫反应的触发机制研究”项目聚焦免疫学科学前沿,对抗原受体TCR(T Cell Receptor)、共刺激受体CD28和共抑制受体PD-1的活化机制展开研究,揭示了免疫受体信号触发的分子机制,提出了“近膜静电调控”的新理论,并进一步验证了该理论对其它膜蛋白的普适性。
该项目还首次提出代谢调控与信号调控联用的肿瘤免疫治疗策略,发展了免疫受体调控的新策略,并验证了其在肿瘤免疫治疗中的应用前景。

许琛琦实验室。
突破对钙离子的传统认知
TCR是免疫系统T细胞表面负责识别抗原的主要受体,它可以引发下游信号通路,激活T细胞免疫反应。
2009年,许琛琦完成博士后训练,在中国科学院上海生物化学与细胞生物学研究所(现中国科学院分子细胞科学卓越创新中心)开设独立课题组。循着前期研究的轨迹,他想到:当T细胞遇到抗原时,TCR磷酸化位点如何从细胞膜上解离下来?
许琛琦团队发现,在T细胞受到抗原刺激后,Ca2+(钙离子)会从胞外流向胞内,导致胞内细胞膜附近的Ca2+浓度瞬时提高,后者能够直接与酸性磷脂带负电的磷酸根结合,中和其负电。酸性磷脂和TCR正电区的相互作用因此减弱,TCR的磷酸化位点暴露出来,磷酸化作用得以进行,从而放大TCR的活化信号。
这项研究于2013年发表于《自然》(Nature)杂志。
在上述论文投稿期间,审稿人向许琛琦提出了一个很难回答的问题:怎么证明钙离子通过电荷功能引发了TCR的磷酸化,而非通过钙离子的信号功能发挥作用?
这个问题很难有一个完美的答案。因为钙离子在细胞内有很多个信号通路,当时的敲除手段有限,研究人员很难把钙离子涉及的所有信号通路都阻断。
实在想不出好的解决办法,许琛琦向《细胞研究》(Cell Research)常务副主编李党生请教。李党生建议引入植物中其他离子的转运蛋白,例如铜离子,看是否可以发挥同样的功能。但这个实验的操作也不简单,需要在人的T细胞里重构一个植物的离子的蛋白,再将这个离子送到细胞里去。
灵感出现在看足球比赛的路上。喜欢看足球赛的许琛琦约李党生一起看上海申花队的比赛,在出租车上继续讨论审稿人的问题。许琛琦忽然想到自己早前读过的一篇文献,提到T细胞上的钙离子通道并不是特异性的,除了可以内流钙离子,还可以内流其他二价阳离子,例如锶离子、钯离子。
他当即给学生施小山打电话,让他试试这两种离子。
实验结果显示,用锶离子代替钙离子具有同样的表型,同时,锶离子在T细胞内没有引发下游钙离子的信号通路。问题迎刃而解。
许琛琦经常在课堂上讲这个故事。“在科学研究中,相互讨论和批评与相互支持一样重要。”他说。
“这个实验设计的出现只是灵光一闪。我们只做了很简单的实验,就回答了一个很难的问题。”许琛琦对澎湃科技记者说,讲这个故事也是希望鼓励学生们相互交流,从不同的角度思考问题。
“刹车”和近膜静电调控
许琛琦团队把CD3ε信号区装到了没有“刹车”机制的CAR(Chimeric antigen receptor,嵌合抗原受体)分子上,取名为E-CAR。
但与天然的TCR分子相比,CAR-T细胞因过度“活跃”而存在寿命较短和副作用风险的缺点。而E-CAR克服了这两个缺点。2020年,这项研究结果发表于《细胞》(Cell)杂志,并入选当年中国生命科学十大进展。
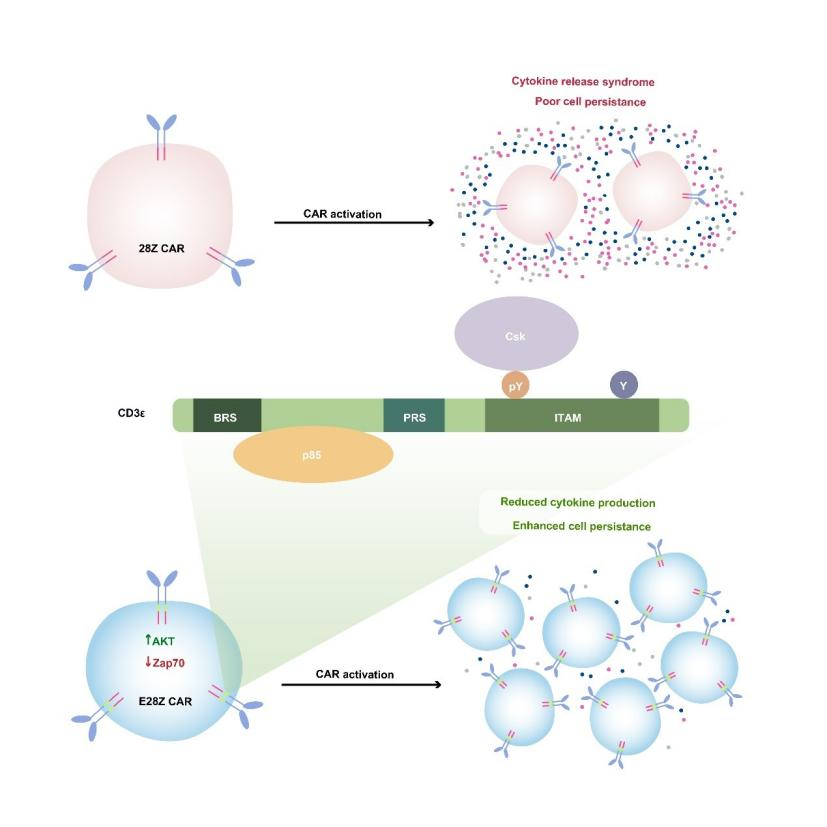
基于CD3e 蛋白多重信号功能而设计的新型CAR-T细胞疗法。
此外,仅有TCR一个信号不足以激活T细胞。即便它被激活,也会马上衰竭,需要共刺激分子CD28的辅助。
许琛琦团队发现,酸性磷脂可以屏蔽CD28的磷酸化位点,钙离子可以通过中和酸性磷脂负电荷来放大CD28信号。该论文于2017年发表于《自然-结构与分子生物学》(Nature Structural & Molecular Biology)。
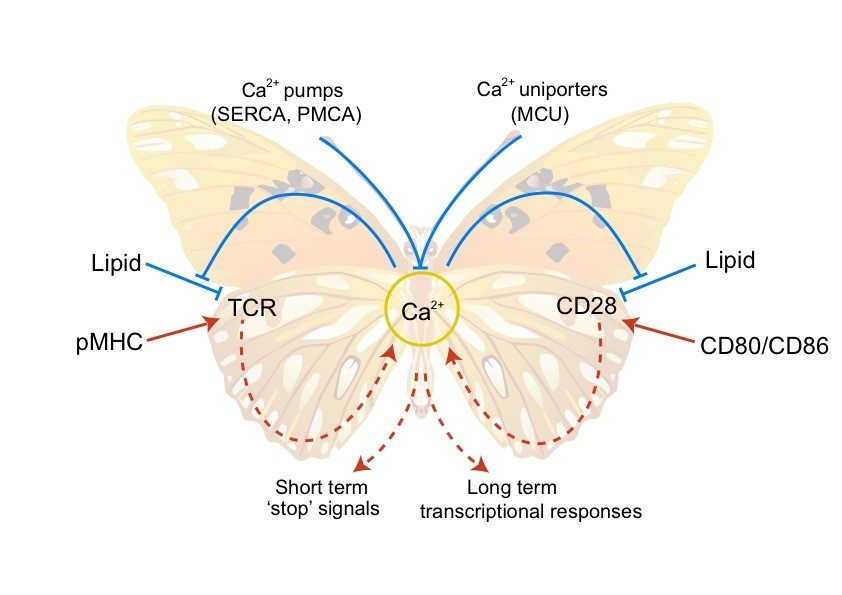
TCR-Ca2+-CD28双环路正反馈模型。
此后在与其他团队合作时,许琛琦团队发现磷脂/钙离子静电调控同样适用于其他多种免疫受体。
由此,许琛琦团队总结性地提出“近膜静电调控”理论,即酸性磷脂可以通过静电相互作用调控免疫受体的构象与功能,钙离子可以中和酸性磷脂的负电荷,从而间接调控免疫受体的活性。
提出代谢调控新策略
2006年,中科院分子细胞科学卓越创新中心原所长李伯良牵头成立“胆固醇代谢平衡调控及其相关重要疾病的代谢组学机理”项目,获得科技部支持。许琛琦加入了这个项目,研究课题是T细胞免疫的胆固醇代谢。
许琛琦团队发现,T细胞的胆固醇水平与其活性和免疫杀伤能力直接相关。
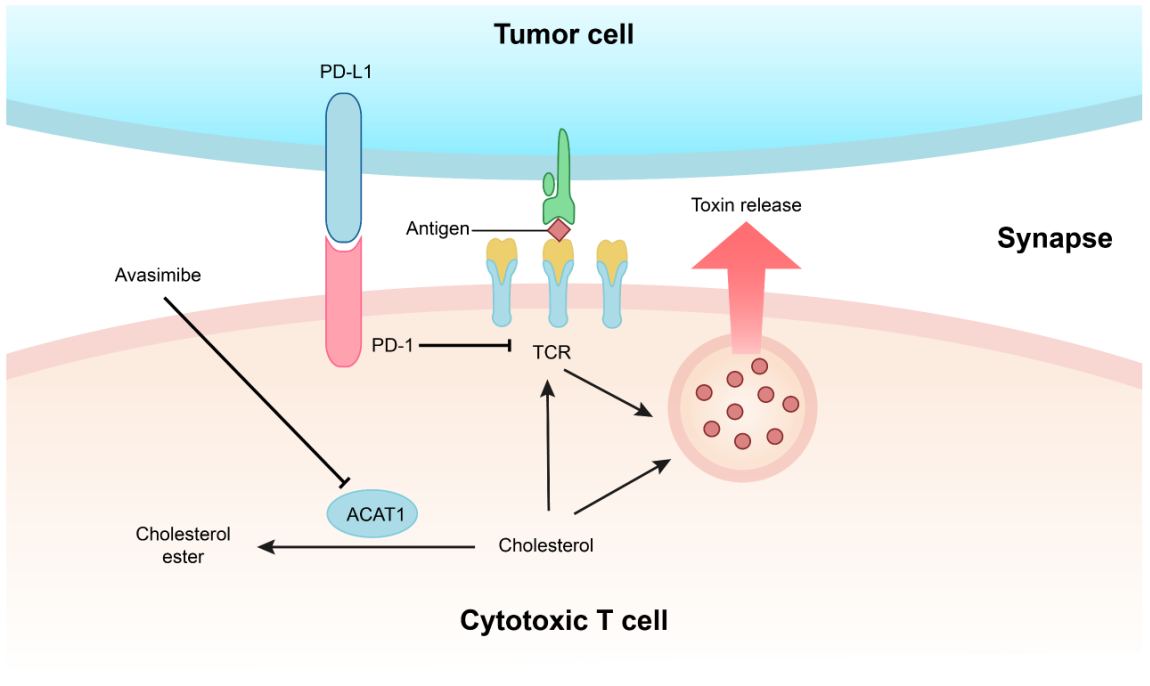
基于胆固醇代谢调控的肿瘤免疫治疗新方法。
“我们想,如果胆固醇是好东西的话,为什么要储存起来?如果抑制胆固醇的储存,让它得到充分利用,能进一步提高T细胞活性。”许琛琦团队研究发现,抑制介导胆固醇储存的酶ACAT1能够有效增强T细胞免疫功能。
进一步,他们使用ACAT1抑制剂Avasimibe在动物模型中治疗多种肿瘤,发现它具有很好的抗肿瘤效应,且该药物与现有的抗PD-1药物联用后效果更佳。
许琛琦介绍,Avasimibe是美国辉瑞公司(PFE.US)研发的心血管疾病药物,在3期临床试验中失败,但成功的1期和2期临床试验证明了其人体安全性。这一发现为肿瘤免疫治疗提供了一个全新的思路,入选2016年中国科学十大进展和中国生命科学十大进展。
“做转化是一件很勇敢的事情,它比发论文更难,在理论层面上,讲清楚某个通路20%的贡献就可以发表一篇好论文,但在实践中,也许这20%的贡献根本没有用。”许琛琦告诉澎湃科技。
虽然许琛琦认为自己不适合做全职创业的科学家,但他仍然希望将自己20年的原创成果转化为真正对人体健康有益的产品。其团队设计的E-CAR现正在两项研究者发起的临床试验中检验有效性和安全性,分别针对肿瘤和自身免疫性疾病。他们还推出了E-CAR2.0版本,计划继续优化。“如果把它看作开店,我希望开一个百年老店,不开分店,专注于将我的产品不断更新换代。”许琛琦说。
基础研究仍将是许琛琦实验室的主要方向,未来的主线将放在抗原免疫和脂代谢上。“大家已经看到TCR-T细胞疗法的应用前景,但背后的一些基础问题仍需回答,例如抗原免疫的特异性到底在哪?我们还会关注脂代谢机制,胆固醇是我们‘试水’的分子,我们会继续研究其他的脂质分子。”