获取更多CSCB2020相关资讯
原始态(Naïve state)多能性相关研究是近年来干细胞及重编程领域的研究热点和难点,与传统的primed状态相比,Naïve态捕获了体内植入前胚胎发育的阶段,具有更强的可塑性,在早期胚胎发育研究及未来临床应用中具有更广阔的前景。在近10年的研究中,科学家们取得了一系列重要进展,已建立了较为稳定的人naïve 态多能干细胞的培养和诱导条件【1,2】,并通过抗体库筛选,发现了一系列能够用来分离、指征和鉴定naïve态多能干细胞及中间细胞群体的特定细胞表面蛋白【3】,为naïve态多能干细胞的纯化、分离以及naïve态诱导和培养体系的进一步优化提供重要基础。然而,目前所鉴定的表面抗原多在 naïve 态建立及维持过程中不发挥重要功能,而其在该过程中的动态及发生的分子机制也仍不清楚。
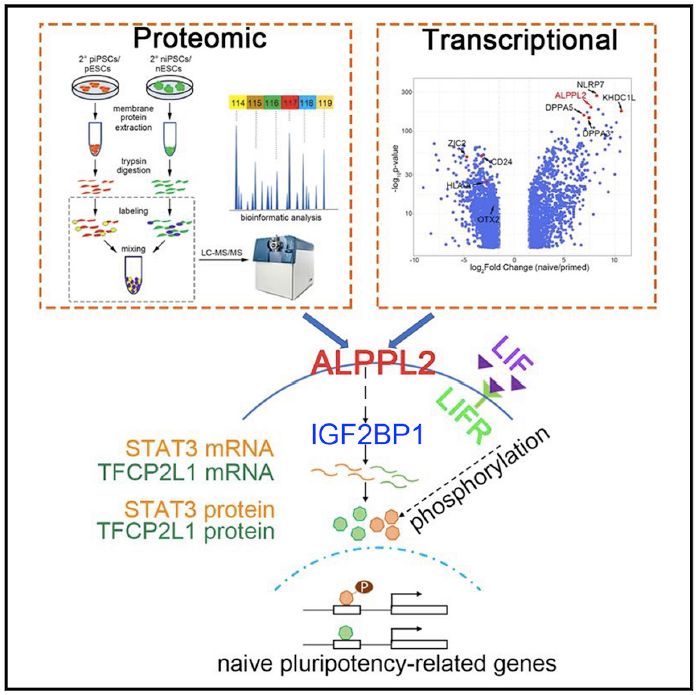
2020年3月17日,同济大学高绍荣教授团队在Cell Reports发表题为“Identification of ALPPL2 as a naïve pluripotent state-specific surface protein essential for human naïve pluripotency regulation”的研究论文,首次鉴定出特异指征人类naïve态多能性的功能性表面分子标志物ALPPL2蛋白,并揭示了其在人naïve态多能干细胞的建立和维持中的重要作用机制。

同时,结合公共naïve/primed多能干细胞转录组数据、体细胞naïve/primed重编程转录组数据、人早期胚胎发育转录组数据,也发现ALPPL2特异地高表达于naïve态细胞中。从而在蛋白水平和转录组水平上分别验证了ALPPL2作为naïve态多能干细胞表面标志物分子的特异性和准确性。此外,在naïve态体细胞重编程、naïve-primed多能性状态转化等多种系统中,利用ALPPL2启动子驱动的报告系统可特异且准确地指征naïve态多能性的建立或退出,进一步验证了该分子对naïve态多能性特异的指征作用。
进一步的研究发现,利用CRISPR/Cas9系统敲除ALPPL2基因会导致naïve态多能性无法正常维持,具体表现为naïve态多能干细胞克隆的形态塌陷,报告系统荧光信号衰减以及naïve态多能性基因STAT3和TFCP2L1等显著下调;此外ALPPL2敲除的体细胞也不能正常的完成naïve态重编程,而对primed态细胞以及primed态重编程则没有明显影响,说明ALPPL2在naïve态多能干细胞的建立和维持中都发挥着重要作用。对此,研究者通过IP和co-IP蛋白互作实验发现了ALPPL2能够与IGF2BP1这一RNA结合蛋白发生紧密的相互作用,并且在naïve态细胞中敲除IGF2BP1的表型和转录谱都与ALPPL2 敲除十分相似,这些实验结果说明IGF2BP1可能是ALPPL2基因发挥作用的下游靶点。此前有研究结果表明IGF2BP1能够识别并结合某些特定的mRNA分子继而调节他们的稳定性和表达水平【4】。
紧接着,作者通过RNA免疫共沉淀技术(RIP)发现IGF2BP1能够特异识别并结合naïve态关键多能性因子STAT3和TFCP2L1 mRNA,稳定其表达。而外源过表达STAT3和TFCP2L1能够一定程度上的恢复ALPPL2或IGF2BP1敲除对naïve态多能干细胞的影响。研究人员还在敲除ALPPL2的naïve态细胞中分别过表达正常的IGF2BP1蛋白和点突变导致功能失活的IGF2BP1蛋白。实验结果发现,正常表达的IGF2BP1也能够一定程度上恢复ALPPL2敲除对naïve态多能干细胞的影响,而失活的IGF2BP1则对ALPPL2敲除后的细胞表型没有明显改变。
综上,这一研究鉴定了能特异性指征人类naïve态多能性的首个功能性表面分子标志物ALPPL2蛋白,并通过其功能机机制研究,深化了对naïve态多能性建立及维持的分子机制的理解,为naïve态建立过程中细胞命运决定机制及naïve态多能性诱导培养体系的优化等后续研究提供基础。
原文链接:
https://doi.org/10.1016/j.celrep.2020.02.090
参考文献
1.Takashima, Y. et al. Resetting transcription factor control circuitry toward ground-state pluripotency in human. Cell158, 1254-1269, doi:10.1016/j.Cell.2014.08.029 (2014).
2.Theunissen, Thorold W. et al. Systematic Identification of Culture Conditions for Induction and Maintenance of Naive Human Pluripotency. Cell Stem Cell 15, 471-487, doi:10.1016/j.stem.2014.07.002 (2014).
3.Collier, A. J. et al. Comprehensive Cell Surface Protein Profiling Identifies Specific Markers of Human Naive and Primed Pluripotent States. Cell Stem Cell 20, 874-890 e877, doi:10.1016/j.stem.2017.02.014 (2017).
4.Huang, H. et al. Recognition of RNA N(6)-methyladenosine by IGF2BP proteins enhances mRNA stability and translation. Nat Cell Biol 20, 285-295, doi:10.1038/s41556-018-0045-z (2018).
来源:BioArt


原标题:《【学术前沿】 高绍荣团队揭示人原始态多能干细胞首个功能性表面标志物ALPPL2在原始态多能性建立和维持中的作用》
