CRISPR系统作为原核生物免疫防御体系的核心组分之一,不仅在细菌抗病毒免疫中占据重要地位,更成为基因编辑技术革命的策源地。近年来的研究发现,DNA靶向CRISPR-Cas9/Cas12系统可能起源于原核生物IS200/IS605转座子超家族中的OMEGA核酸内切酶家族,其中CRISPR-Cas12系统演化自TnpB核酸内切酶,而CRISPR-Cas9系统则源自IscB/IsrB核酸内切酶,这类发现为理解基因编辑工具的分子演化过程提供了重要的理论框架【3-6】(详见BioArt报道:Nat Biotechnol|王皓毅/张勇合作开发新型TnpB微型基因编辑工具;Nature | 基因编辑工具箱或再添神器——TnpB核酸内切酶 ;Science | 张锋团队再发文:源于IS200/605转座子家族的多种核酸酶或可成为基因编辑新工具 )。尽管DNA靶向CRISPR系统的起源与演化图谱已逐渐明晰,RNA靶向CRISPR-Cas13系统仍缺乏系统性的演化溯源研究。
2025年2月18日,来自美国Broad研究所的张锋实验室在Cell发表题为Reprogrammable RNA-targeting CRISPR systems evolved from RNA toxin-antitoxins的论文。文章建立了一种综合的序列/结构整合分析策略,对RNA靶向CRISPR-Cas13系统的起源与演化进行了探索。研究指出Cas13很可能从III型毒素-抗毒素(TA)系统AbiF演化而来。研究者还通过冷冻电镜对AbiF结构进行解析,揭示了Cas13从AbiF演化分离的关键结构性改变。

为深入探究Cas13的演化过程,研究者首先聚焦于具有双HEPN结构域的Cas13样蛋白c13c1,CRISPR关联分析证实c13c1是一种Cas13效应蛋白。随后研究者从计划从HEPN超家族入手对Cas13谱系进行分析,但考虑到HEPN超家族蛋白的序列和结构多样性,研究者设计了一种结构与序列混合的同源搜索策略开展相关研究。通过对原核宏基因组数据库的90亿种蛋白进行序列和结构聚类,研究者鉴定出八组主要的蛋白簇,其中一组包含Cas13、c13c1和两类AbiF/Abi-2样蛋白。研究者在该组蛋白中还识别出两种新的蛋白家族F13a1和F13a2,它们具备与Cas13类似的双HEPN结构域,并与Cas13b和AbiF的单HEPN结构域有同源性。之后的结构比较、序列相似性和系统发育分析提示,AbiF、F13a1/2、c13c1和Cas13a/b/c/d蛋白可能具有共同的祖先AbiF,其中c13c1和F13a1/2很可能是AbiF向Cas13演化过程的关键中间体。
后续全面系统的ncRNA-蛋白关联搜索发现AbiF与ncRNA之间存在高度稳定且显著的关联性,并很可能存在功能关联,其中与AbiF相关的ncRNA被称为AbiFr。进一步分析指出,AbiFr很可能通过 RNA链依赖的机制参与宿主-病原体互作。研究者还通过系统发育分析,发现AbiF、F13a1和c13c1均存在相关ncRNA,表明从AbiF到Cas13的演化过程中,顺式编码的ncRNA是其中的一个关键特征。
研究者之后对c13c1的生化特性进行了分析,发现c13c1能结合成熟的crRNA,并具备RNA引导的RNA切割活性。研究还发现,c13c1是一种高活性的非特异RNA核酸酶,其酶活可被crRNA有效抑制,并在crRNA-目标RNA结合时完全激活。基于以上结果,研究者认为c13c1是VI型CRISPR的亚类,因此重命名为Cas13e。
研究者还对Cas13的潜在祖先蛋白AbiF进行了功能解析。大肠杆菌中的异源表达及活性实验显示,AbiF是一种包含两个核心组分的III型毒素-抗毒素(TA)系统,其中具有假结结构的ncRNA是抗毒素,AbiF是RNA酶蛋白毒素。生化实验发现,AbiF是一种ssRNA特异性核酸酶,能剪切加工对应的ncRNA,并具备类似Cas13的非特异切割活性。研究发现,AbiF的核酸酶活性能被对应的AbiFr ncRNA有效抑制。之后,研究者通过冷冻电镜对PbAbiF RNP复合物结构进行了解析。结果显示PbAbiF的HEPN功能域是四螺旋折叠,与之相对的是,Cas13包含的四螺旋折叠HEPN功能域呈现出循环排列的特性。研究还发现,PbAiF RNP复合物是对称二聚体构象,两个单体的HEPN功能域是面对面互作,每个单体核心活性区的残基紧密靠近聚拢于2重对称轴。此外,每个PbAbiF单体均结合一份ncRNA分子,最终形成对称的RNP复合物,这与其它已知的III型TA系统类似。此外,复合物结构中可观察的ncRNA 49个核苷酸会形成两个堆叠的螺旋结构,基部螺旋螺旋富含GC而远端螺旋会形成复杂的发夹结构,可能对AbiFr ncRNA整体结构的稳定性有所帮助。双螺旋之间存在相对保守的单链凸起(32-38位核苷酸),可与AbiF蛋白形成特异性的碱基相互作用。后续的突变实验证实,ncRNA的C32和U38位点能抑制AbiF的RNA切割活性。
最后,研究者通过整合序列和结构信息对Cas13的演化路径进行梳理。分析指出,AbiFr ncRNA在演化过程中发生明显扩展,会从单一发夹结构扩展到双发夹结构。此外,AbiF蛋白很可能发生了基因复制和融合,形成可结合AbiFr ncRNA的双HEPN蛋白,从而形成了F13a1/2系统。之后F13a1/2系统不再与ncRNA抗毒素协同演化,这为crRNA的出现和互作提供空间,并推动Cas13e1的出现。此过程中,蛋白结构的变化使之能结合crRNA茎环,其中REC螺旋域的插入能增强crRNA-目标RNA结合的稳定性,这可以促进复合物对特异性目标RNA的识别。之后Cas13演化涉及更多更复杂的结构性改变。此外,催化活性演化方面,从AbiF到Cas13,其旁切活性作为核心功能一直得以保留。Cas13e作为演化中间体,同时具备TA和CRISPR系统的特征,其crRNA既能引导靶向目标RNA,又能作为抗毒素发挥功能。随着Cas13e向Cas13a演化,apo Cas13e的非特异性RNA酶活性消失,标志着TA系统完成了向CRISPR的转化。
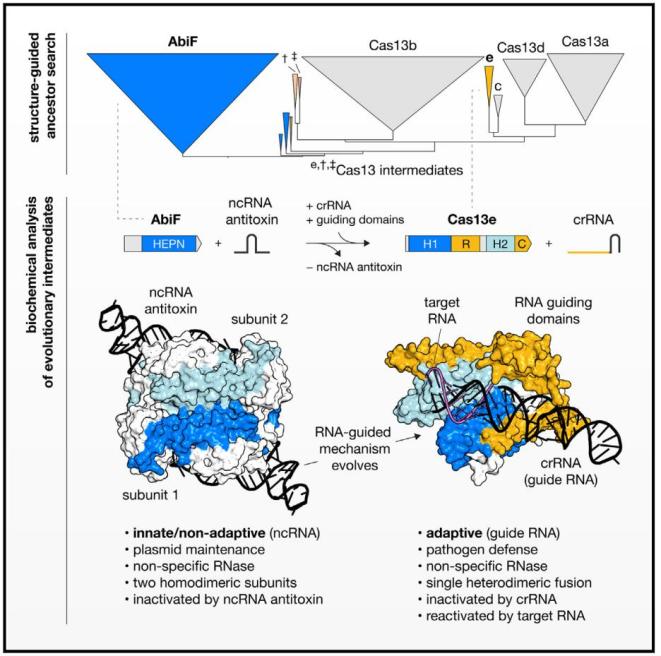
总体而言,研究者通过广泛的序列挖掘、基于深度学习的结构预测,以及序列与结构有机整合的分析方法,对CRISPR-Cas13的演化和起源进行了综合分析,发现毒素-抗毒素(TA)系统AbiF是潜在的祖先蛋白。研究还发现了一种潜在的演化中间体Cas13e,是AbiF/Cas13家族中已知最小的RNA导向核酸酶。本研究系统解析了可编程的RNA导向CRISPR系统从非RNA导向系统演化的可能路径,也为宿主和病原体间持久的军备竞赛中免疫系统的演化提供了新的见解。
原文链接
https://doi.org/10.1016/j.cell.2025.01.034
来源:BioArt
扫码关注我们
网址:www.cscb.org.cn
微信:CSCB-Wechat
*祝贺《Cell Research》入选中国科技期刊卓越行动计划二期项目
《Cell Regeneration》2024年获得创刊以来的第一个影响因子4.0
点分享
点收藏
点在看
点点赞
继续滑动看下一个轻触阅读原文

细胞世界向上滑动看下一个
原标题:《【前沿进展】Cell | 张锋团队揭示RNA靶向CRISPR-Cas13系统的起源与演化》
