肝细胞癌(hepatocellular carcinoma,HCC)是最主要的原发性肝癌类型和最致命的癌症之一。TGF-β和Hippo信号在肝脏的稳态调控中发挥重要作用,其信号异常变化与包括肝癌在内的各种肝脏疾病的发生发展相关。但是,TGF-β和Hippo信号对话(signaling crosstalk)是否和如何影响肝癌发展仍待阐明。

近日,南昌大学基础医学院严晓华团队在国际生物化学期刊Journal of Biological Chemistry杂志上发表了题为“Upregulation of CYR61 by TGF-β and YAP signaling exerts a counter-suppression of hepatocellular carcinoma”的研究论文(2024 Mar 21:107208.)。该研究联合肝癌数据库和转录组测序分析,发现CYR61基因是一个与肝癌发展密切相关的潜在因子;实验发现,TGF-β信号激活的Smad2/3与Hippo信号下游的YAP/TEAD4能够以相互依赖的方式结合CYR61基因启动子,并共同刺激其启动子活性和基因转录;功能上,CYR61能够诱导一个抗肿瘤的基因转录程序,降低多个促癌基因的表达水平,并抑制TGF-β和YAP诱导的肝癌细胞恶性转化和肝癌生长,因此形成一个负反馈调控机制;临床组织样本检测发现,肝癌组织中CYR61表达水平较正常肝组织降低,从而解除了其抑癌作用。该研究揭示了 TGF-β和Hippo信号在肝癌中的对话新机制,阐述了CYR61抑制肝癌发展的新功能。
(1)CYR61作为调控肝癌发展的关键候选基因
为了深入了解肝细胞癌(HCC)的发病机制,研究者首先利用TCGA和GEO公共数据库,分析了HCC组织与正常肝脏组织之间的差异表达基因(DEG)共219个(图1A)。同时,研究者使用TGF-β1重组蛋白分别刺激三种HCC细胞系4小时并进行转录组测序(RNA-Seq),分析发现共有463个基因表达受TGF-β调控(图1A)。通过比较公共数据库挖掘结果和TGF-β靶基因数据,鉴定出9个潜在因子可能与肝癌发展密切相关,包括CYR61(图1A-1C);这些基因经实验证实在HCC细胞系中受TGF-β信号调控(图1D)。
接下来,研究者重点分析了CYR61基因。与正常肝组织相比,大多数临床肝癌组织样本中CYR61表达水平明显下调(图1E-1F);TCGA-LIHC数据库分析显示,无论是分析所有的、配对的还是分期的肝癌组织样本,其CYR61表达水平都比正常肝组织降低(图1G-1I),且CYR61低表达与HCC患者的不良预后相关(图1J)。
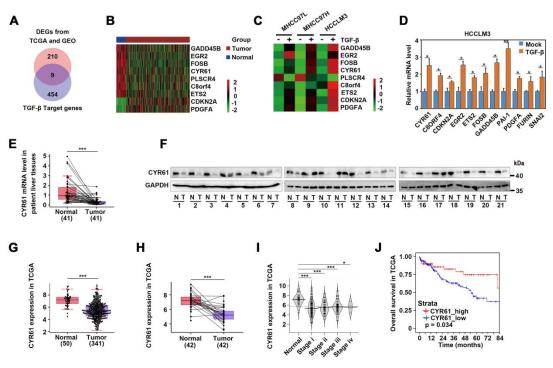
图1. CYR61作为与HCC发展相关的关键候选基因。
(2)TGF-β和YAP/TEAD4信号通路共同诱导CYR61基因转录
研究者首先验证了TGF-β对CYR61的转录调控作用,并在CYR61基因启动子区鉴定到2个Smad蛋白结合元件(Smad-binding element,SBE)(图2A-2D);有趣的是,TGF-β对CYR61基因的诱导作用不仅依赖于Smad蛋白,而且依赖于Hippo信号下游的转录激活因子YAP/TAZ(图2A-2E)。另一方面,使用Hippo通路的激酶抑制剂XMU-MP-1处理细胞或过表达YAP,也可以刺激CYR61基因启动子活性和基因表达(图2F-2G);且双荧光素酶报告基因实验发现,Smad蛋白和YAP/TEAD4不仅能共同诱导CYR61基因的启动子活性,而且依赖于YAP-TEAD4之间的相互作用(图2H-2K)。最后,ChIP-PCR检测发现Smad2/3和YAP/TEAD4以相互依赖的方式结合CYR61基因启动子(图2L-2O)。
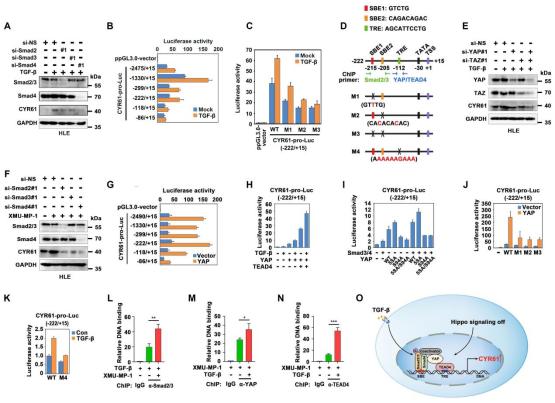
图2. TGF-β和YAP/TEAD4信号通路协同诱导CYR61基因转录
(3)CYR61抑制TGF-β和YAP诱导的肝癌进展
TGF-β和YAP在肝癌进展中都发挥重要的促癌作用。研究显示,CYR61缺失能够有效地促进TGF-β或YAP介导的肝癌细胞生长和增殖等(图3A-3C);反之,过表达CYR61则能抑制TGF-β或YAP介导的肝癌细胞迁移、侵袭、生长和增殖等(图3D-3I)。在体内,过表达YAP(5SA)促进肝癌异种移植瘤的生长,而同时过表达CYR61改善了这种生长作用(图3J-3L),且降低了移植瘤样本中Ki-67的表达水平(图3M)。因此,尽管CYR61在转录水平上被TGF-β和YAP信号上调,但它在TGF-β/YAP介导的肝癌进展中发挥抑癌作用,形成一个反馈调控作用(图3N-3O)。

图3. CYR61抑制TGF-β和YAP诱导的肝癌进展
(4)TEAD4以不依赖于YAP的方式抑制TGF-β信号和肝癌发展
此外,该团队还以“Tea domain transcription factor TEAD4 mitigates TGF-β signaling and hepatocellular carcinoma progression independently of YAP”为题在Journal of Molecular Cell Biology期刊上发表了另一项相关的研究(2023 Jun 13;15(2):mjad010.)。在YAP信号失活状态下,TEAD4能与Smad2/3形成复合物,减弱组蛋白乙酰转移酶p300与Smad2/3的结合及其与TGF-β靶基因启动子的结合,从而抑制TGF-β诱导的促癌基因表达,如TGF-β1、JunB、SOX4和IL-11等;功能上,TEAD4减弱TGF-β诱导的肝癌细胞体外增殖、迁移与侵袭能力,以及裸鼠体内的肝癌异种移植瘤(xenograft)生长;与野生型TEAD4类似,不结合YAP/TAZ的突变体蛋白(TEAD4-K297A)也能抑制TGF-β信号和肝癌生长。
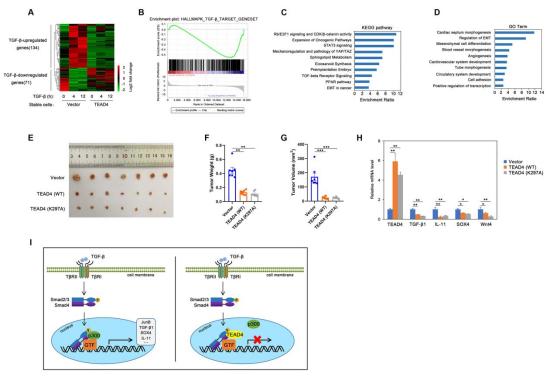
图4. TEAD4以不依赖于YAP/TAZ的方式抑制TGF-β信号和肝癌发展
结论、讨论与展望
综上所述,上述研究揭示了TGF-β信号和YAP/TEAD4信号之间复杂的对话关系及其在肝癌中的功能。Smad蛋白和YAP/TEAD4不仅能在乳腺癌等肿瘤中共同诱导一些促癌基因表达,从而促进肿瘤发展,同时也能在肝癌中诱导肿瘤抑制因子表达,如CYR61,进而限制TGF-β/YAP的促癌作用,形成反馈调控作用;但是,一些原因导致了CYR61在肝癌中表达下调,从而解除其抑癌作用并促进肝癌发展。CYR61/CCN1和CTGF/CCN2都是胞外基质蛋白,都属于CCN蛋白家族成员,也都是TGF-β/YAP靶基因;与CTGF主要发挥促癌作用不同,CYR61在肿瘤中的作用似乎与肿瘤类型和发展阶段相关。另外一方面,上述研究也留下了一些有趣的问题值得后续深入研究,如(1)作为胞外基质蛋白,CYR61是否影响肿瘤细胞和微环境基质细胞的互作?(2)TGF-β和YAP信号都是重要的抗肿瘤免疫的抑制因子,CYR61是否影响肝癌的免疫微环境而发挥其抑癌作用尚不清楚;(3)是否能够利用更多的小鼠遗传模型和肝癌模型进一步在体内证明CYR61的抑癌作用,并揭示可能的靶向干预策略?上述问题的回答有助于全面和深入地认识CYR61在肿瘤中的功能与机制。
作者简介
严晓华,南昌大学基础医学院教授、独立PI、博士生导师,南昌大学实体肿瘤分子靶向医药基础研究创新中心副主任。2010年获清华大学细胞生物学博士学位,曾任清华大学副研究员,2016年聘为南昌大学“学科方向带头人”高层次引进人才;入选江西省“双千计划”创新领军人才,获江西省“杰青”项目资助。长期从事细胞信号转导和肿瘤发展相关研究,在J Biol Chem、Cell Mol Life Sci、J Mol Cell Biol、Cell Res、Nat Commun、iScience、Sci China Life Sci等期刊发表SCI论文40余篇。担任中国细胞生物学学会理事、中国生物化学与分子生物学会理事、《Acta Biochim Biophys Sin》和《生命的化学》期刊编委、《J Mol Cell Biol》期刊青年编委等。
原标题:《【前沿进展】JBC & JMCB | 南昌大学严晓华团队揭示TGF-β和Hippo信号对话新机制及其在肝癌发展中的功能》
