哺乳动物的生命起始于卵子和精子通过受精作用形成全能性的受精卵,经过一系列的细胞分裂、八细胞期的极化、以及随后的桑葚胚开始的谱系分化,形成包含有内细胞团(ICM)、原始内胚层(PE)和滋养外胚层(TE)的囊胚(1)。 这一过程伴随着显著的代谢重塑,比如从早期卵裂时期的相对比较静息的状态(此时的胚胎依赖于丙酮酸和乳酸),到后期囊胚时期的相对比较活跃的状态(此时多用葡萄糖的氧化代谢作为营养物质的来源)(2)。2021年张进课题组和胡泽平课题组联合报道了小鼠二细胞时期和囊胚期胚胎的代谢图谱,并探索了代谢物L-2-HG参与早期表观遗传重塑的潜在机制(3)。除了小分子代谢物之外,细胞中存在种类繁多的脂质分子,然而,脂质代谢对哺乳动物早期胚胎发育的调控作用还不清楚。
脂类在多种生物学事件中具有重要的作用,包括能量的存储与代谢、细胞的增殖与分化,以及作为信号转导分子参与信号通路(4, 5)。2013年研究人员描述了果蝇发育过程中的脂代谢重塑(6)。2016年科学家探索了斑马鱼在发育过程中,卵黄内脂类加工与动态变化的过程(7)。 然而,哺乳动物早期胚胎发育过程中完整的脂类重塑的全景图还尚不存在。
2024年2月1日,浙江大学基础医学院/浙江大学医学院附属第一医院/良渚实验室张进团队,中国科学院遗传与发育生物学研究所税光厚团队,中国医科大学附属盛京医院生殖医学中心李达团队在 Nature Cell Biology 期刊上发表了题为 Low input lipidomics reveals lipid metabolism remodelling during early mammalian embryo development的研究论文,该项工作系统描绘了小鼠和人早期胚胎发育过程中动态变化的脂质图谱,并阐明了脂质不饱和度调控胚胎发育的功能与机制。


首先,研究人员通过高分辨率质谱靶向脂质组学分析平台,实现了在少量胚胎(120个植入前胚胎)水平上进行代谢物的检测,可以鉴定到23大类脂质共300余种脂质分子,包括甘油磷脂、鞘脂和中性脂。为了能够提供精确全面的脂质全景图,研究者首先使用基于异丙醇(IPA)的单相提取方法提取脂质,IPA对于磷脂类脂质有较好的恢复效果;接着用Bligh & Dyer的方法对相同数量的胚胎进行第二次检测,这种方法对于中性脂类有较好的恢复效果,两种方法互为验证获得了一致的全局模式的脂质组重塑数据。
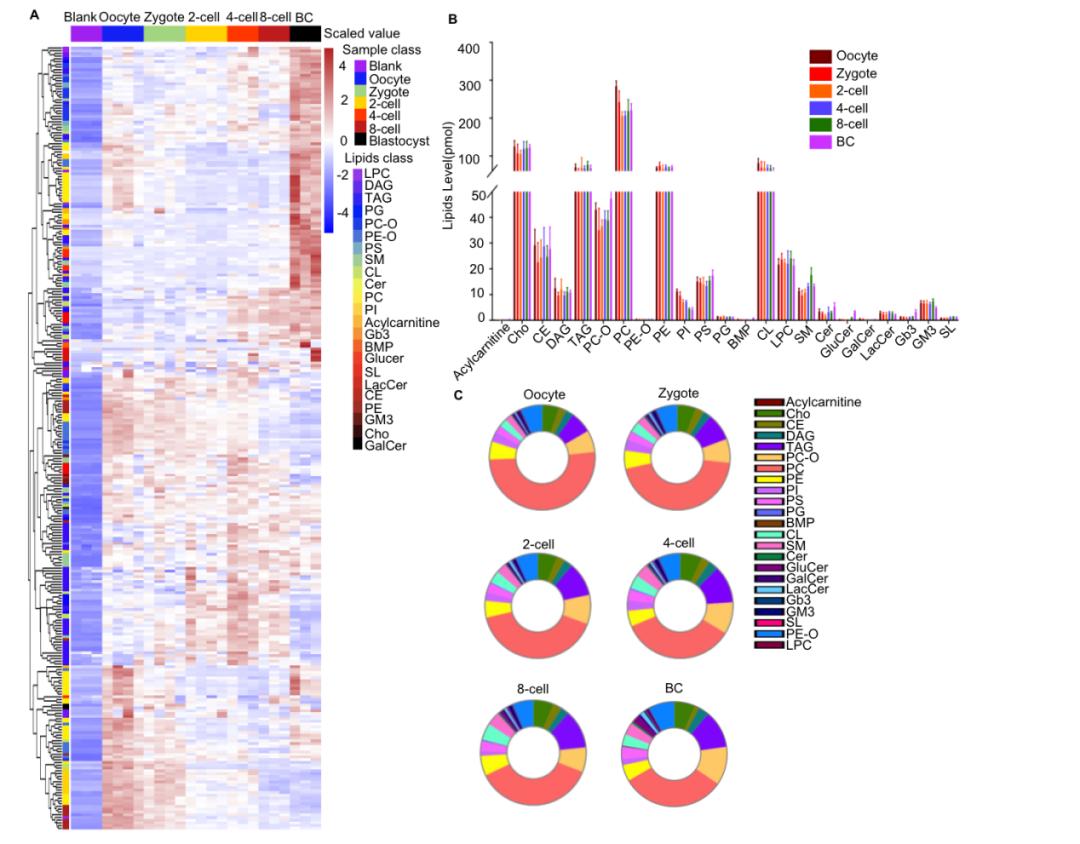
图一,小鼠植入前胚胎发育的阶段特异性脂质组学特征
为了了解植入前发育过程中每个脂质类别的动态变化和功能,研究人员将检测到的脂类分为三大类,第一类是鞘氨醇脂质,主要由神经酰胺、鞘磷脂(SMs)和鞘糖脂(GSLs)组成,在细胞膜上形成专门的微结构域,促进信号转导。含有胆固醇(Cho)的SM不仅是参与信号转导的脂筏(lipid raft)必需的细胞结构成分,也是细胞分裂和分化所必需的。分析表明,大多数SM脂质分子在向囊胚发育的过程中变得更加富集,并且(SM+Cho)/PC指示脂筏微结构域的比率在这个过程中增加,与胚胎的活体脂筏染色结果一致,表明在发育过程中,脂筏的形成增加,从而适应囊胚时期增强的信号转导。
第二类是磷脂,磷脂是细胞膜的主要成分,以磷脂酰胆碱(PCs)的含量在每一个时期中最为丰富。分析发现,PCs的丰度呈双峰分布,在卵母细胞和囊胚阶段具有更高的水平,特别是在囊胚阶段富集了更多具有不饱和脂肪酰基链的PC(PC38-PC42)。磷脂酰乙醇胺(PEs)的丰度自卵母细胞开始稳步下降,与PCs不同,其在囊胚中没有表现出再升高。PC和PE主要存在于质膜的外叶和内叶中,因此,这些结果表明在发育过程中特异的膜成分的动态重塑。磷脂酰肌醇(PIs)在卵母细胞和受精卵中最高,并随着发育逐渐减少。PIs可以作为信号分子发挥作用,在卵母细胞发育过程中,PIs磷酸化的水解产物1,4,5-三磷酸肌醇(IP3)可以识别并结合内质网膜表面的IP3受体,导致Ca2+释放到胞质溶胶中,并在受精时促进卵母细胞活化。
第三类是中性脂,甘油三酯(TAG)的含量在四细胞开始至囊胚期有明显的增加,TAG是脂滴的主要成分,主要功能之一是提供能量,提示TAG可以为后期氧化活动的增强提供原材料。
磷脂的组成和不饱和度对膜的流动性有很大影响,脂质组学分析显示,随着发育的进行,碳碳双键的数量和碳链长度均增加。与二细胞期胚胎相比,多不饱和的脂质在囊胚中更加富集。此外,单/双不饱和脂质与饱和脂质的比例,或多不饱和脂质与饱和脂质的比例显示出明显的双峰的趋势,即在二细胞期胚胎阶段较低,在卵母细胞和囊胚阶段较高。囊胚阶段比二细胞阶段具有更高的脂质不饱和度和链长这一现象也在单个脂质类别(如PC)统计中得到了验证(图二)。
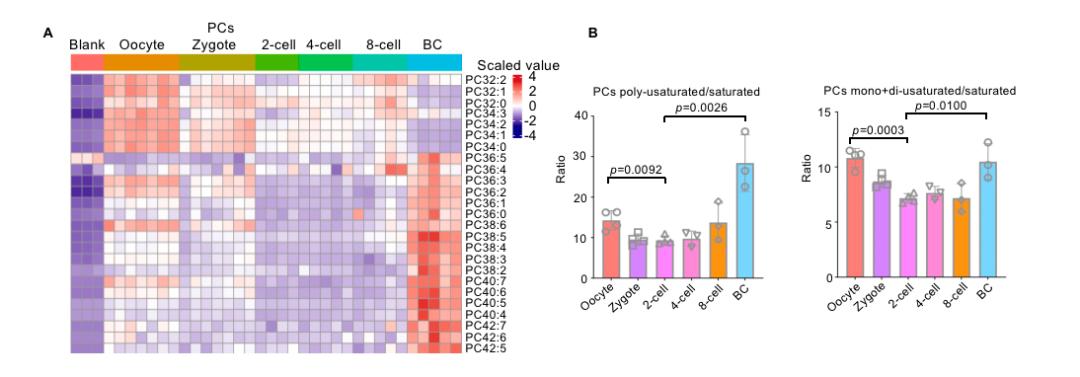
图二,小鼠早期胚胎发育中的不饱和度变化
而在人类早期胚胎发育过程中,由于实验材料的稀缺,内源的代谢物和脂质分子的动态变化及其对胚胎发育的影响还鲜有研究。在上述以小鼠为模式生物研究的基础上,研究人员对人的八细胞胚胎和囊胚期胚胎进行了脂质组学检测,发现从脂质种类到发育过程中脂质变化趋势(如TAGs,CLs增高,PEs,PIs下降)以及不饱和度增高方面均存在物种之间的保守性。
研究人员进一步通过转录组学分析,发现ICM阶段的脂代谢基因富集了用于合成不饱和脂肪酸的基因,一些关键的脂类分子去不饱和酶的表达水平也在这一过程中显著上调,包括Δ5, Δ6 和Δ9 酶。Δ9 (stearoyl-CoA desaturase, SCD)负责在饱和脂肪酸如棕榈酸(palmitic acid, C16:0) 和硬脂酸(stearic acid, C18:0) 的碳端的第9-10号位之间形成不饱和键,从而生成单不饱和脂肪酸(MUFA)棕榈油酸(palmitoleic acid, C16:1) 和油酸(oleic acid, C18:1)。而Δ5和Δ6 (Fatty Acid Desaturase 1, FADS1, Fatty Acid Desaturase 2, FADS2) 酶则进一步参与产生多不饱和脂肪酸(PUFA) (8)。其中去饱和酶SCD1在囊胚期的表达最为丰富,提示该基因可能对小鼠囊胚发育有重要的作用。同时,研究人员检测了C16:0、C18:0、C16:1和C18:1的总水平,并观察到与二细胞胚胎相比,囊胚中C18:1的含量和C18:1/C18:0的比例增加,并且以单个类别的PI最为明显。通过小分子抑制剂和基因干预的方法抑制SCD1/Scd1,研究人员发现下敲Scd1降低了囊胚的形成率,在培养液中添加油酸可以有效的挽救囊胚形成,证明Scd1介导的脂质的单不饱和度增加是囊胚形成的重要因素。
该研究进一步探索了脂质不饱和度如何调控囊胚形成的分子机制。研究人员对下敲Scd1的囊胚进行RNA-seq分析,通过基因富集分析发现,与微管运动和细胞膜锚定相关基因的表达有影响,而在早期胚胎发育过程中,细胞骨架蛋白如肌动蛋白微丝(actin filaments),微管蛋白(microtubules)和中间丝状体蛋白(intermediate filaments,如 keratin)的分布可以促进卵裂球极性(polarity)的形成,即顶端结构域(apical domain)和基底外侧结构域(basolateral domain)的形成(9)。研究人员通过免疫染色实验发现囊胚时期,抑制SCD1的活性可导致细胞骨架蛋白,如keratin8(K8)和keratin18(K18)不能正确分布。
此外,Δ6和Δ5去饱和酶也有相似的作用,相关抑制剂处理会导致囊胚形成率下降,细胞骨架组织破坏和细胞-细胞边界模糊,而这一现象可以通过补充多不饱和脂肪酸如ω-6的花生四烯酸(ARA)和ω-3的二十碳五烯酸(EPA)来挽救。
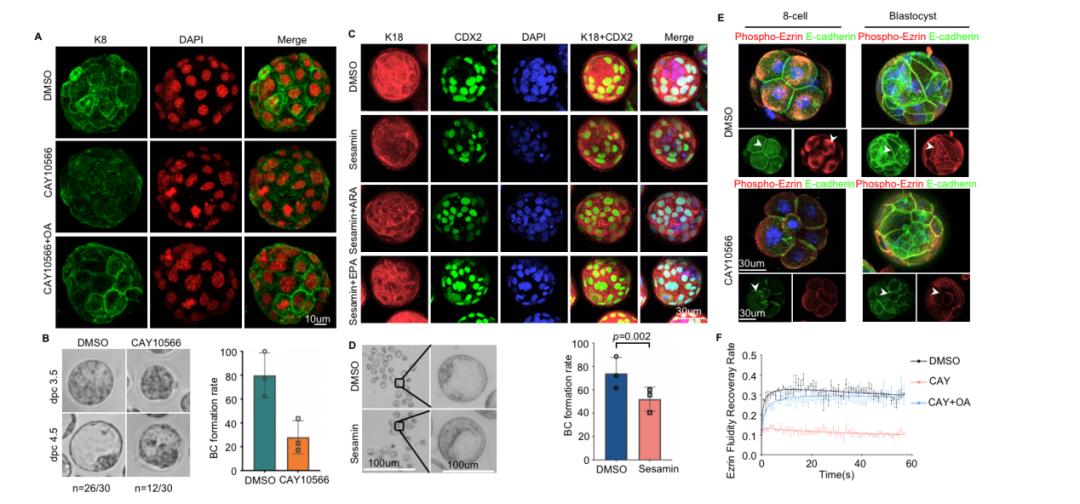
图三,去饱和酶SCD1有助于囊胚的形成以及顶端-基底端极性的建立。
研究表明,在八细胞胚胎形成后,会产生卵裂球极性建立的现象,该过程由一系列精密调控的极性蛋白(aPKC, Ezrin)、细胞骨架蛋白(keratin8,keratin18)和脂质分子(PIP2)协同完成(9,10)。在八细胞胚胎向囊胚发育的过程中,Ezrin和Actin等蛋白都会通过在质膜上的侧向流动,从顶端结构域转移到基底端。研究人员发现Scd1下敲的八细胞胚胎中,磷酸化的Ezrin流动性下降,导致其连接的keratin8和keratin18蛋白分布变得均匀,标志细胞之间的界限变得模糊;此外,位于基底端的蛋白E-cadherin在八细胞和囊胚期的表达和分布亦有明显下降和变化,提示Scd1介导的脂质单不饱和度通过影响极性蛋白流动性,调控骨架蛋白的正确分布,保证胚胎发育正常进行。
小鼠早期胚胎从八细胞发育到囊胚阶段需要顶端和基底外侧结构域的形成,以建立顶端-基底极性,促进囊胚的形成和扩张,并支持囊胚在子宫中的植入。研究人员发现,将Scd1下敲的胚胎移植进假孕母鼠体内,胚胎的着床率下降,蜕膜(decidua)数目减少。最后研究人员也分别用体外干细胞系和类囊胚系统进行验证:通过在ESC和TSC中抑制合成单不饱和与多不饱和脂肪酸的酶的活性,骨架蛋白keratin8/keratin18, E-cadherin, 以及磷酸化的Ezrin的表达和分布都会受到影响;而在胚胎干细胞中添加SCD1的抑制剂可以减少类囊胚的形成效率,验证了脂质不饱和度上调对囊胚形成的必要性。
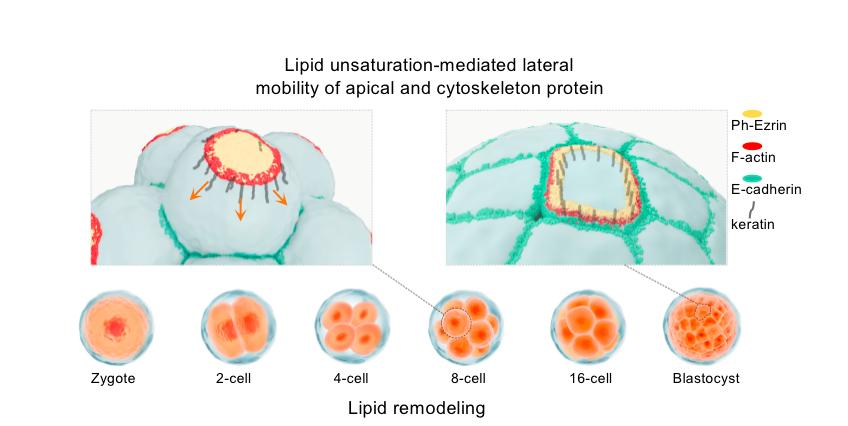
图四,脂质不饱和度调控卵裂球极性的建立和囊胚的形成
浙江大学的张进教授,中国科学院遗传与发育生物学研究所税光厚研究员,中国医科大学附属盛京医院生殖医学中心李达教授为本文的通讯作者,浙江大学良渚实验室特聘副研究员张玲,浙江大学良渚实验室特聘副研究员赵静,中国科学院遗传与发育生物学研究所Sin Man Lam研究员, 浙江大学博士生陈浪,中国医科大学附属盛京医院生殖医学中心助理研究员高应卓,浙江大学博士生王文杰为本文的共同第一作者,浙江大学叶存奇研究员,李炫臻研究员,周全研究员,沈宁研究员为本研究提供了重要帮助。研究受到了国家自然科学基金委,浙江省自然科学基金委的支持。
张进团队一直致力于代谢调控哺乳动物早期胚胎发育的研究,深耕积累了一系列研究成果,相关工作先后发表在Cell Metab (2018), Nat Metab (2021), Development(2023), Nat Cell Biol (2024) 杂志上。
该团队在2018年2月在 Cell Metabolism 上发表了“Metabolism in Pluripotent Stem Cells and Early Mammalian Development”的综述,阐述了多能干细胞中代谢通过影响表观遗传修饰参与基因调控,代谢通路调控在胚胎发育和干细胞命运决定中的作用,并提出绘制哺乳动物早期胚胎发育中代谢图谱的重要意义。
2021年10月, 该团队与清华大学的胡泽平课题组合作,在Nature Metabolism上发表了题为“Metabolic remodelling during early mouse embryo development”的研究论文。系统绘制了小鼠早期胚胎发育过程中二细胞和囊胚期的小分子代谢物图谱,并探索了代谢物L-2-HG参与调控早期表观遗传修饰的潜在分子机制。
2023年10月该团队在Development 上发表了题为“Dynamic metabolism during early mammalian embryogenesis”的综述,总结了哺乳动物卵母细胞和早期胚胎发育过程中的代谢特点,并提出了“发育代谢物”调控发育的观点。
2024年1月团队在Nature Cell Biology 上发表的“Low input lipidomics reveals lipid metabolism remodeling during early mammalian embryo development” 的研究论文,系统地描绘了小鼠和人早期胚胎脂质全景图,为研究哺乳动物植入前胚胎发育中内源性脂质的重塑提供了宝贵的资源,并为脂质不饱和度调节胚胎发育和植入提供了机制上的新的见解。
论文链接:
1. Rossant J. Genetic Control of Early Cell Lineages in the Mammalian Embryo. Annual review of genetics. 2018;52:185-201.
2. Zhang J, Zhao J, Dahan P, Lu V, Zhang C, Li H and Teitell MA. Metabolism in Pluripotent Stem Cells and Early Mammalian Development. Cell metabolism. 2018;27:332-338.
3. Zhao J, Yao K, Yu H, Zhang L, Xu Y, Chen L, Sun Z, Zhu Y, Zhang C, Qian Y, Ji S, Pan H, Zhang M, Chen J, Correia C, Weiskittel T, Lin DW, Zhao Y, Chandrasekaran S, Fu X, Zhang D, Fan HY, Xie W, Li H, Hu Z and Zhang J. Metabolic remodelling during early mouse embryo development. Nature metabolism. 2021;3:1372-1384.
4. van Meer G, Voelker DR and Feigenson GW. Membrane lipids: where they are and how they behave. Nature reviews Molecular cell biology. 2008;9:112-24.
5. Simons K and Toomre D. Lipid rafts and signal transduction. Nature reviews Molecular cell biology. 2000;1:31-9.
6. Guan XL, Cestra G, Shui G, Kuhrs A, Schittenhelm RB, Hafen E, van der Goot FG, Robinett CC, Gatti M, Gonzalez-Gaitan M and Wenk MR. Biochemical membrane lipidomics during Drosophila development. Developmental cell. 2013;24:98-111.
7. Fraher D, Sanigorski A, Mellett NA, Meikle PJ, Sinclair AJ and Gibert Y. Zebrafish Embryonic Lipidomic Analysis Reveals that the Yolk Cell Is Metabolically Active in Processing Lipid. Cell reports. 2016;14:1317-1329.
8. Nakamura MT and Nara TY. Structure, function, and dietary regulation of delta6, delta5, and delta9 desaturases. Annual review of nutrition. 2004;24:345-76.
9. Lim HYG and Plachta N. Cytoskeletal control of early mammalian development. Nature reviews Molecular cell biology. 2021;22:548-562.
10. Zhu M, Cornwall-Scoones J, Wang P, Handford CE, Na J, Thomson M and Zernicka-Goetz M. Developmental clock and mechanism of de novo polarization of the mouse embryo. Science (New York, NY). 2020;370.
原标题:《【前沿进展】张进/税光厚/李达团队报道哺乳动物生命起始时期的脂代谢重塑全景图》
