非经典分泌 (unconventional protein secretion, UcPS) 途径是缺乏信号肽的分泌蛋白的运输途径,该分泌途径不依赖于ER-Golgi【1-3】,其分子机理尚不明确。此前,清华大学葛亮课题组发现了一个膜蛋白TMED10介导的非经典分泌途径,并将该通路命名为THU (TMED10-channeled UcPS)【4,5】。TMED10介导UcPS货物跨膜转运到内质网-高尔基体中间体 (ER-Golgi intermediate compartment,ERGIC),从而起始囊泡依赖的非经典分泌途径。该通路的生理功能尚待揭示。
2024年1月8日,清华大学生命科学学院葛亮和陈晔光课题组合作在Cell Research期刊在线发表了题为TMED10-mediated unconventional secretion of IL-33 regulates intestinal epithelium differentiation and homeostasis的短论文,报道了THU通路的一个重要生理功能,发现TMED10通过调控肠上皮中IL-33的非经典分泌 (以及其他来源的IL-33) 影响肠上皮分泌型细胞谱系的分化,并能够抵御肠炎。

在本研究中,作者首先利用肠上皮特异性敲除小鼠,发现TMED10在肠上皮细胞中发挥着促进分泌型细胞分化的作用,进而通过DSS诱导的肠炎模型发现TMED10蛋白能够抵御肠炎。结合小鼠小肠分泌液中分泌蛋白检测、单细胞数据分析以及TMED10敲除细胞系中过表达TMED10全长或者截短体实验发现并验证了IL-1家族分泌蛋白IL-33受到TMED10调控。IL-33蛋白回补能够挽救TMED10敲除导致的杯状细胞以及潘氏细胞数量的降低,并能够抵御DSS诱导的肠炎。
为了进一步研究IL-33分泌蛋白作用于TMED10下游,在肠上皮中的作用,作者引入IL-33肠上皮敲除小鼠以及TMED10、IL-33肠上皮双敲小鼠,验证了IL-33作为TMED10调控的非经典分泌蛋白在TMED10调控肠上皮细胞分化过程中发挥作用。结合此前关于IL-33在肠上皮中的研究【6-8】作者提出如下模型:THU调控肠上皮细胞分泌IL-33,后者通过作用于ILC2细胞调控上皮细胞分化和肠稳态(图1),同时由于IL-33蛋白回补无法完全恢复分化细胞数量及改善肠炎症状,可能存在TMED10调控的其他非经典分泌蛋白或者TMED10蛋白除非经典分泌外的其他功能在这一过程中发挥作用【9】。
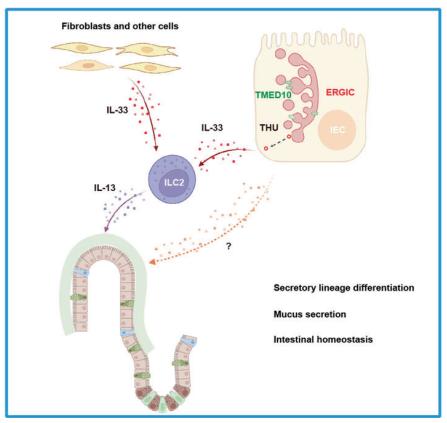
图1. THU调控IL-33非经典分泌影响肠上皮分化和肠稳态
综上,该研究利用介导THU途径的关键蛋白TMED10敲除小鼠,揭示了非经典分泌THU途径的一个重要生理功能,即THU调控小肠上皮分泌细胞谱系的分化并抵御肠道炎症,为系统性揭示THU的生理功能和病理异常开启了第一扇门。
清华大学生命科学学院博士后王洋、2018级博士生黄美梅及2020级博士生穆相悦为共同第一作者,清华大学生命学院助理研究员刘媛、教授陈晔光和副教授葛亮为共同通讯作者。
原文链接:
https://www.nature.com/articles/s41422-023-00891-3
制版人:十一
参考文献
1. Nickel, W. and C. Rabouille, Mechanisms of regulated unconventional protein secretion. Nat Rev Mol Cell Biol, 2009. 10(2): p. 148-55.
2. Rabouille, C., V. Malhotra, and W. Nickel, Diversity in unconventional protein secretion. J Cell Sci, 2012. 125(Pt 22): p. 5251-5.
3. Zheng, J. and L. Ge, Diverse cellular strategies for the export of leaderless proteins. National Science Open, 2022. 1(3).
4. Zhang, M., et al., A Translocation Pathway for Vesicle-Mediated Unconventional Protein Secretion. Cell, 2020. 181(3): p. 637-652 e15.
5. Zhang, M., et al., Translocation of interleukin-1β into a vesicle intermediate in autophagy-mediated secretion. eLife, 2015. 4.
6. Ngo Thi Phuong, N., et al., IL-33 Drives Expansion of Type 2 Innate Lymphoid Cells and Regulatory T Cells and Protects Mice From Severe, Acute Colitis. Front Immunol, 2021. 12: p. 669787.
7. Zhu, J., et al., IL-33 alleviates DSS-induced chronic colitis in C57BL/6 mice colon lamina propria by suppressing Th17 cell response as well as Th1 cell response. Int Immunopharmacol, 2015. 29(2): p. 846-853.
8. Seo, D.H., et al., Interleukin-33 regulates intestinal inflammation by modulating macrophages in inflammatory bowel disease. Sci Rep, 2017. 7(1): p. 851.
9. Pastor-Cantizano, N., et al., p24 family proteins: key players in the regulation of trafficking along the secretory pathway. Protoplasma, 2016. 253(4): p. 967-85.
原标题:《【学术前沿】Cell Research丨葛亮/陈晔光合作揭示THU通路调控小肠上皮分泌细胞谱系分化并抵御肠道炎症》
