原创 程前 梅峰 细胞世界 收录于合集 #神经细胞生物学 45个
学钢琴的人反复练习一首陌生曲目,从凝滞顿挫到行云流水;杂技演员摸索一套复杂的新动作,从笨拙出错到精彩绝伦……这些现象背后的功臣之一,是大脑可塑性。
大脑可塑性是机体应对环境变化和学习新技能的重要机制,而大脑可塑性的发生则有赖于神经元之间突触联系的建立。近十年来,研究发现其实大脑的髓鞘(myelin)也具有可塑性,也参与调节脑功能。什么是髓鞘?它们如何调节脑功能?如果大脑的髓鞘出了乱子,又会怎样?
且看下文分解。
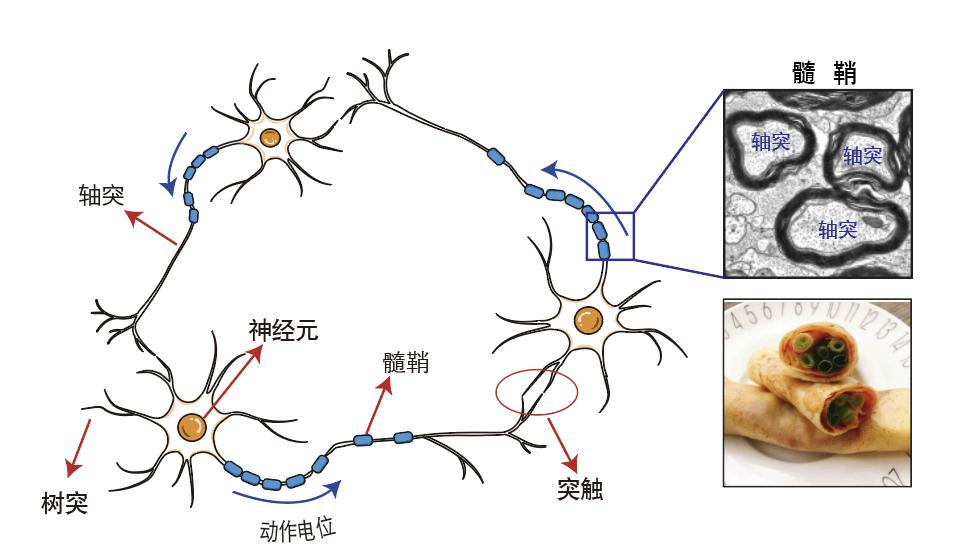
图1:神经元与髓鞘
01 以神经元轴突为支架
髓鞘是由髓鞘形成细胞在神经元轴突上形成的结构,你可以在上图中找到那些小家伙们。
神经元细胞的突起分为轴突(Axon)和树突(Dendrite)。树突膜突起会形成大量的树突棘(Spine),与其他神经元轴突的终末形成突触结构(Synapse),接收来自其他神经元轴突的信息(图1)。轴突是神经元唯一的传出结构,短的仅几十微米,最长可达几十厘米,大量轴突汇合成神经纤维束和白质。神经纤维作为动物体内信息传递的桥梁,就像复杂的电信网络,时刻传递海量信息。每一根神经纤维就像一段电线,大脑中上亿的神经元就是由这些神经纤维相互连接成一个整体发挥功能。髓鞘则是包裹在轴突上的多层细胞膜结构,富含脂类,使轴突绝缘。在透射电子显微镜下可以看到包裹轴突的高电子密度结构(图1右上图)。髓鞘和轴突的关系就像是一张煎饼(髓鞘)包了一根大葱(轴突)(图1 右下图,来源于网络)。
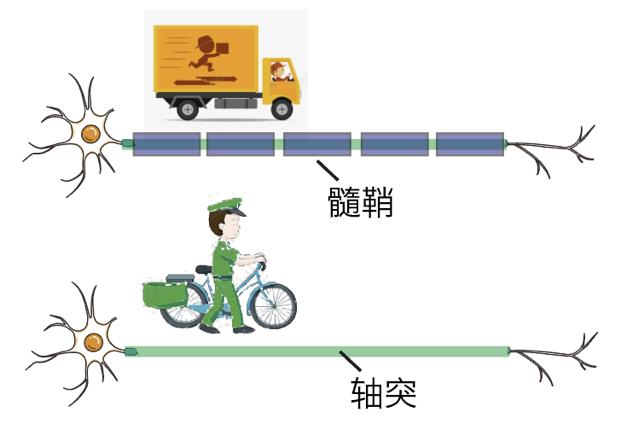
图2:髓鞘与神经传递
02 为快而生
髓鞘是为了提高神经冲动传递速度而产生的结构,是生物进化的产物,像未出现下颌的低等动物就没有髓鞘。动物神经冲动的传导速度提高了,反应速度变快了,生存几率自然更大了。
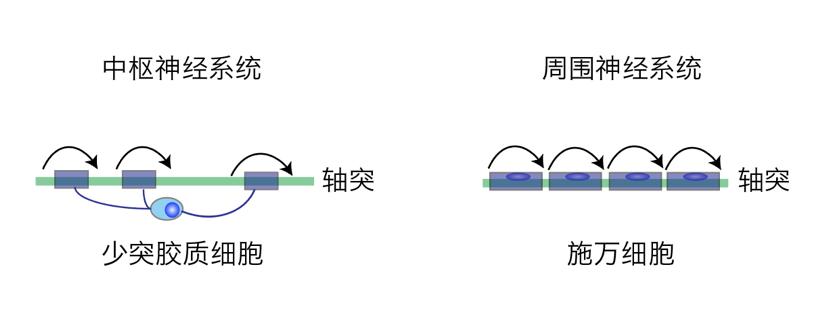
图3:中枢和周围神经系统的髓鞘
也许你会问:为了提高传导速度,只有形成髓鞘这一个办法吗?那倒不是。我们知道,电线的电流强度是由电压和电阻素决定,电阻越小电流就越大。同理,轴突的电阻越小,传递速度就越快。一些生物通过增加轴突直径来提高传导速度,例如巨型章鱼的轴突直径可以达到0.5-1毫米,而人脑轴突的直径范围为0.2-20微米[1]。但轴突直径越大,消耗能量更多,所占据的体积也更大,导致难以形成复杂的网络。
那么试试形成髓鞘这个策略吧!髓鞘对轴突的包裹呈节段性,相邻髓鞘节段中间含有一段裸露的部分,被称为郎飞结(Node of Ranvier),相邻郎飞结间的髓鞘节段被称为结间体。日本科学家Ichiji Tasaki的研究发现,郎飞结处的电势极高,可以轻易穿过1~2个结间体[2]。髓鞘化轴突的动作电位传导为跳跃式,这种方式的传导速度较无髓鞘轴突更快,且耗能更少。如果把动作电位传递比喻成送信件,开车的快递员肯定比骑自行车的邮递员要快(图2,来源于网络)。所以,髓鞘显著提高了轴突传递神经信号的效率。
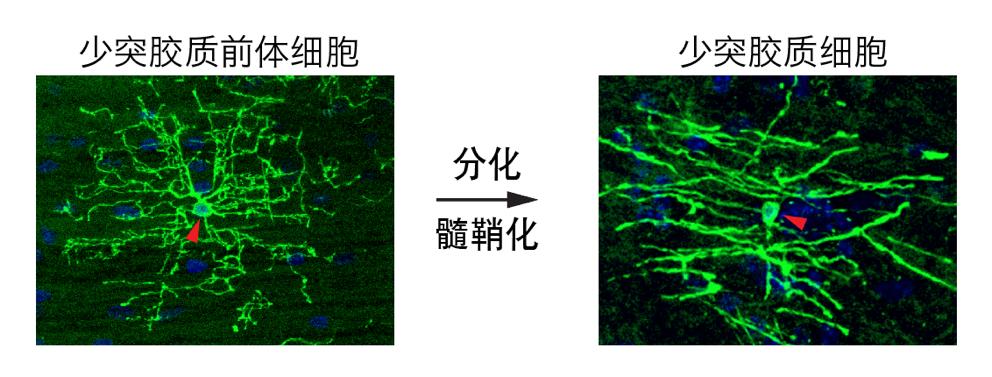
图4:少突胶质前体细胞和少突胶质细胞
03信息传递的“红绿灯”
髓鞘能提高传导速度,但中枢神经系统的髓鞘与周围神经系统的髓鞘却不尽相同。哺乳动物有两种髓鞘形成细胞:一种是施万细胞(Schwann cell),主要分布在周围神经系统,每个细胞形成一个髓鞘节段;另外一种是少突胶质细胞(Oligodendrocyte,OL),主要分布在中枢神经系统(包括脑和脊髓),每个细胞形成10-50个髓鞘节段(图3),且髓鞘节段数量保持稳定 [3]。少突胶质细胞是一种终末细胞,由少突胶质前体细胞(Oligodendrocyte precursor cells, OPCs)分化而来(图4)。
从神经传导特性来说,如果周围神经系统是十二车道的高速公路,那么中枢神经系统就是布满十字路口的都市大街。两者的区别在于,前者神经元轴突往往长距离传输信号,要求快速、准确、节能;而后者神经元轴突的长短不一,有分支,中途到达多个下游树突(图3),在这种情况下,快慢得当、协同性、同步性更重要。所以,周围神经系统轴突上的髓鞘通常都是连续的,与准确、快速传递信息相适应[4]。而中枢神经系统轴突的髓鞘分布模式千变万化,可以间断,连续,间断和连续相间,甚至可以没有髓鞘。就像城市复杂的交通网络,快慢得当才能协调大脑的多个神经元或核团的同步活动。
不仅如此,在学习和记忆等脑功能训练中,成熟少突胶质细胞形成髓鞘的数量基本不变,但是长短、厚薄均可发生变化(图5,模式一)。此外,少突胶质前体细胞可分化成新的少突胶质细胞,而少突胶质前体细胞又终生存在于中枢神经系统中,成年后髓鞘的数量仍可持续增多。这种模式改变就像路口的红绿灯一样调节信息传递的速度(图5,模式二,来源于网络)。中枢神经系统髓鞘的动态变化,被认为可以改变神经冲动传递的速度和强度,从而提高神经元核团间的同步性,参与调节脑功能,被称为髓鞘可塑性。
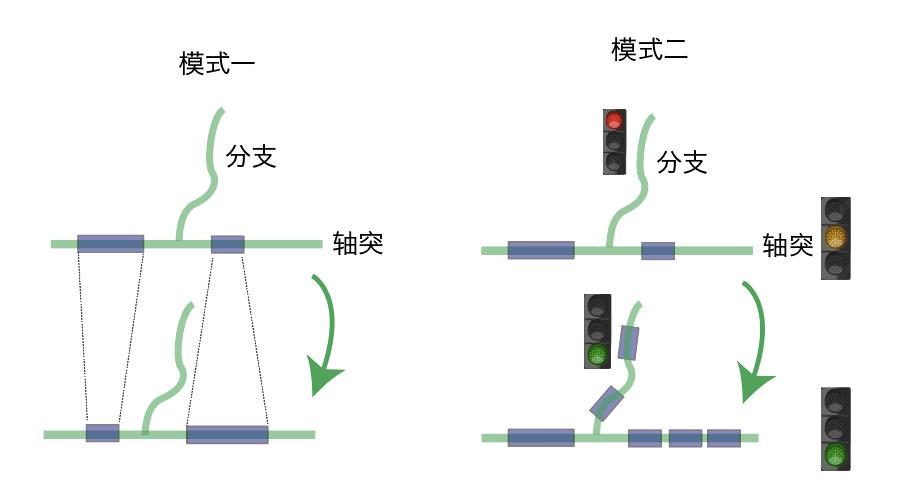
图5: 髓鞘动态变化模式与信息传递
04 与髓鞘相关的疾病
近十年来,科学研究发现髓鞘可塑性参与大脑的复杂功能,例如学习、记忆、感觉和视力等方面[5-7]。髓鞘丢失(脱髓鞘,图6)会导致神经功能异常,例如学习、记忆、视力、运动等方面。
比如说,多发性硬化症(MS)是一种常见的中枢神经系统脱髓鞘疾病,年轻人高发,在我国的发病率逐年上升。MS的病因是自身免疫系统攻击髓鞘导致中枢神经系统脱髓鞘。脱髓鞘的区域散在分布,由于累及的区域不同,症状具有多样性。患者可出现肢体无力、共济失调、感觉异常、慢性疼痛、视神经炎、肢体震颤、精神异常等。虽然成年大脑中存在大量少突胶质前体细胞,但是在脱髓鞘疾病中,髓鞘形成常常延迟且不完全。髓鞘缺失不但直接造成神经功能障碍,更重要的是脱髓鞘轴突更易发生退化,导致永久性神经功能损害[8-9]。
研究发现,神经退行性疾病也可伴有脱髓鞘的现象。例如:最近的研究发现阿尔茨海默病(AD)疾病早期出现脱髓鞘的现象,髓鞘总量的减少比神经元轴突退化出现得更早。采用转基因或药物促进髓鞘形成后,AD小鼠的空间记忆能力部分恢复[10]。因此,促进髓鞘再生可能是治疗髓鞘相关疾病的方法之一。
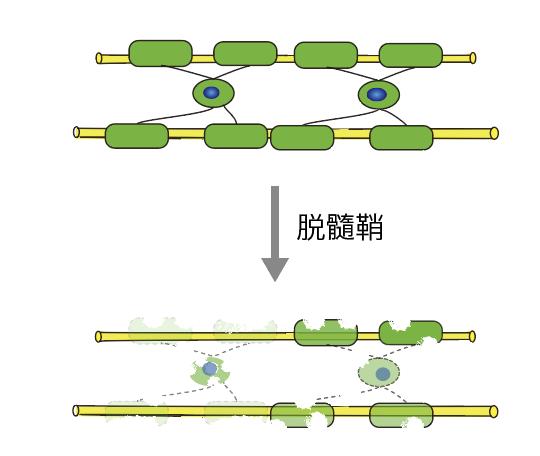
图6: 脱髓鞘模式图
综上所述,髓鞘使轴突绝缘从而保证动作电位跳跃式传导,髓鞘通过改变神经冲动的传导时间从而协调不同神经元之间的信息传递。大脑髓鞘调节神经冲动的“快慢之道”是人脑可塑性的重要基础之一。我们期待着,随着对髓鞘调节脑功能机制的理解不断深入,能够发现更多有效的调节髓鞘形成药物,使髓鞘成为相关疾病治疗的重要靶点。
作者简介
程 前 陆军军医大学基础医学院硕士研究生
梅 峰 陆军军医大学基础医学院教授,主要研究髓鞘可塑性调控脑功能的机制。
参考文献
Shigeno, S., Tsuchiya, K., & Segawa, S. Embryonic and paralarval development of the central nervous system of the loliginid squidSepioteuthis lessoniana. The Journal of Comparative Neurology, 437(4), 449–475 (2001).
Boullerne, A. I. The history of myelin. Experimental Neurology, 283, 431–445 (2016).
Wanner IB, Mahoney J, Jessen KR,Wood PM, Bates M, Bunge MB. Invariant mantling of growth cones by Schwann cell precursors characterize growing peripheral nerve fronts. Glia 54:424–38 (2006).
Carla Taveggia, M. Laura Feltri. Beyond Wrapping: Canonical and Noncanonical Functions of Schwann Cells. Annu. Rev. Neurosci. 2022. 45:561–80 (2022).
Steadman, P. E. et al. Disruption of oligodendrogenesis impairs memory consolidation in adult mice. Neuron 105, 150–164.e6 (2020).
Pan, S., Mayoral, S. R., Choi, H. S., Chan, J. R. & Kheirbek, M. A. Preservation of a remote fear memory requires new myelin formation. Nat. Neurosci. 23,487–499 (2020).
Fei Wang, Shu-Yu Ren. Myelin degeneration and diminished myelin renewal contribute to age-related deficits in memory. Nature Neuroscience 2020, 23, 481–486 (2020).
Irvine, K. A. & Blakemore, W. F. Remyelination protects axons from demyelination-associated axon degeneration. Brain 131, 1464–1477 (2008).
Franklin, R. J. M. & Ffrench-Constant, C. Remyelination in the CNS: from biology to therapy. Nat. Rev. Neurosci. 9, 839–55 (2008).
Chen, J. F, et al.. Enhancing myelin renewal reverses cognitive dysfunction in a murine model of Alzheimer’s disease. Neuron. 109: 2292–2307 (2021).
特别鸣谢:
中国细胞生物学学会神经细胞生物学分会进行科普审稿
原标题:《【科学普及】髓鞘:神经冲动传递的“快慢之道”》
