原创 Cell Press CellPress细胞科学

生命科学Life science
嗅觉作为一种在演化过程中古老且高度保守的感觉,对于动物的生存、繁衍和社交均具有重要意义。嗅觉的产生起始于嗅觉神经元中表达的嗅觉受体对外界气味信息的识别,美国科学家Linda Buck和Richard Axel(2004年诺贝尔生理学或医学奖得主)参照GPCR领域奠基人Robert J. Lefkowitz(2012年诺贝尔化学奖得主)1986年克隆β肾上腺素受体的方法,于1991年发现了嗅觉受体亚家族[1]。嗅觉受体具有GPCR特征性的七次跨膜结构,Buck和Axel认为它们只在嗅觉组织中表达,因此早期研究主要集中于其对嗅觉功能的调控。然而,近年来的研究表明,嗅觉受体在非嗅觉组织广泛表达并调控重要的生理功能,提示其或可作为新型药物靶点[2]。近年来,一些中国年轻学者在嗅觉受体的非嗅觉组织功能研究领域取得了重要进展。例如,清华大学王一国教授团队发现肝脏中表达的嗅觉受体Olfr734通过感知白脂素,调控糖代谢稳态的机制;山东大学于晓教授和孙金鹏教授发现Olfr109在胰岛中表达,并识别胰岛素不完整短肽或者变性胰岛素启动胰岛的刹车机制;浙江工业大学李汉兵教授团队和中国农业大学仝涛教授团队等在异位嗅觉受体相关研究中亦有出色工作。近日,山东大学基础医学院的于晓教授团队和孙金鹏教授团队在Cell Press细胞出版社旗下期刊Trends in Cell Biology合作发表了题为“Emerging roles of olfactory receptors in glucose metabolism”的综述文章,系统地阐述了嗅觉受体在糖代谢相关组织中的表达模式和生理功能,深入分析了嗅觉受体的信号转导机制,并对其在代谢性疾病中的治疗潜力进行了展望。
嗅觉受体在糖代谢组织中的表达
嗅觉受体属于G蛋白偶联受体(GPCR)超家族,是哺乳动物最大的蛋白家族之一。自1991年嗅觉受体家族被发现以来,越来越多的证据表明嗅觉受体在非嗅觉组织尤其是糖代谢相关组织(胰岛、肝脏、脂肪和肾脏等)中的表达,提示其在糖代谢中发挥调控作用[3]。
嗅觉受体在不同组织中表达量差异较大,总体而言,嗅觉受体在糖代谢组织中的表达水平要低于其在嗅上皮中的表达水平(图1)。通过分析小鼠肝脏单细胞测序结果,研究者发现嗅觉受体在糖代谢组织中存在类似于嗅觉系统“one neuron–one receptor”(即每个嗅觉神经元只表达一种嗅觉受体)的表达模式。此外,嗅觉受体在嗅上皮组织中存在区域选择性表达,对于嗅觉感知编码非常重要,而其在糖代谢组织是否存在类型的表达模式尚不明晰。未来应用单细胞和时空组学相结合的技术,有望精准解析嗅觉受体在糖代谢组织的表达特征,有助于进一步理解嗅觉受体的调控作用。
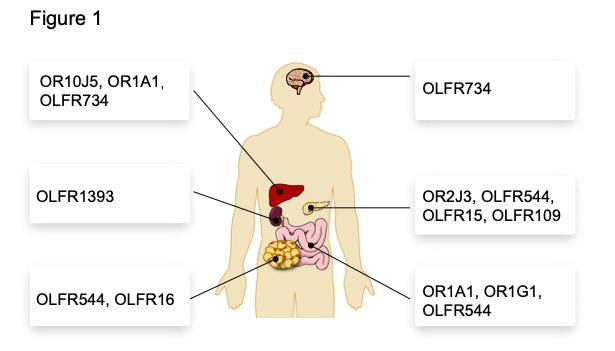
▲图1. 嗅觉受体在糖代谢相关组织的表达
嗅觉受体在糖代谢中的功能
嗅觉受体通过调控激素分泌、脂肪代谢、胰岛素敏感性等,在血糖稳态维持过程中发挥重要作用。例如胰岛β细胞特异表达的Olfr109通过感知变性胰岛素或胰岛素短肽insB:9-23抑制胰岛素分泌,影响胰岛稳态[4];肝脏中的Olfr734作为白脂素的受体,促进肝脏糖异生[5]。脂肪组织中Olfr544被壬二酸激活调控脂肪代谢,可以改善糖尿病模型小鼠的葡萄糖耐量和胰岛素耐量[6]。肾脏近曲小管中表达的Olfr1393调节钠-葡萄糖协同转运蛋白的表达和定位,影响葡萄糖重吸收[7]。
血糖稳态的维持,除了依赖于不同组织之间的交流,也与组织内不同细胞类型之间的精密协作密不可分。于晓和孙金鹏团队前期研究发现,胰岛β细胞表达的Olfr109被不成熟的胰岛素片段长期激活,导致炎症因子CCL2的分泌,从而促进胰岛内驻留巨噬细胞的增殖,诱发胰岛炎症和糖尿病发生[4]。该结果表明嗅觉受体在糖代谢组织中功能性细胞环路的形成和维持过程发挥重要作用。
糖代谢相关嗅觉受体的配体
迄今为止,约20%的人源嗅觉受体被脱孤儿化,其配体大多数是天然或合成的气味化合物,以及部分短链脂肪酸等。嗅觉受体不仅能感知气味分子和脂肪酸,还能结合多肽和蛋白质,例如胰岛素片段insB:9-23和白脂素分别被鉴定为Olfr109和Olfr734的内源性配体。糖代谢相关嗅觉受体结合气味分子的亲和力通常较低(微摩级),而其结合多肽/蛋白配体的亲和力很高(纳摩级)。另外多肽配体结合嗅觉受体的模式与气味分子存在较大差异,气味分子主要结合在受体的TM3以及TM5-7区域,而胞外环ECL2则在多肽配体的识别过程中发挥重要作用。除了正构结合位点,最近的研究发现嗅觉受体同时存在别构位点,可以调控不同气味分子的协同作用[8]。未来对糖代谢嗅觉受体更多高亲和内源性配体的挖掘,以及气味分子和多肽/蛋白分子协同作用的研究,将增进我们对嗅觉受体在糖代谢调控中的理解,并有可能发展出特异性的别构配体。
糖代谢相关嗅觉受体的偏好性信号
糖代谢相关嗅觉受体通过偶联不同的G蛋白发挥调控作用。例如OR10J5、OR1A1、Olfr734和Olfr544激活Gs或Golf,Olfr15偶联Gq,而Olfr109激活Gi蛋白(图2)。除了G蛋白信号通路,嗅觉受体还能够募集β-arrestin。Olfr109即通过β-arrestin-1介导的信号通路在β细胞-巨噬细胞交流和胰岛免疫稳态调控中的发挥关键作用。“偏好性信号通路”是GPCR研究领域的前沿热点,对于靶向GPCR的药物开发具有重要意义[9]。Olfr109的相关研究表明嗅觉受体下游的Gi蛋白信号和β-arrestin信号通路分别调控不同的功能,其中Gi通路介导的胰岛素分泌“刹车机制”可在短期内保护β细胞免于衰竭,而β-arrestin通路则引发胰岛炎症反应,损害胰岛稳态。因此,利用嗅觉受体下游功能特异性信号通路发展偏好性配体、改善糖代谢,或将为代谢性疾病的防治提供新的思路。

▲图2. 糖代谢相关嗅觉受体的G蛋白偶联特征及信号通路
嗅觉受体在代谢疾病中的治疗潜力
嗅觉受体作为一类独特的GPCR亚家族,其成员众多并在糖代谢中发挥重要调控作用,具备成为治疗代谢性疾病新型药物靶点的潜力。但是直接应用气味分子的药物开发面临亲和力低、易脱靶、生物安全性未知等困难,给“气味疗法”的应用带来很大挑战。而嗅觉受体多肽配体的发现开始凸显其治疗潜力,通过对配体关键氨基酸进行改造或修饰,有可能开发出选择性的激动剂或拮抗剂,对肥胖症和糖尿病等疾病具有潜在治疗价值。另外靶向嗅觉受体的新型配体开发(如pepducin和纳米抗体等)也备受关注。例如针对Olfr109的第二个胞内环设计的特异性拮抗剂,可以显著改善糖尿病模型小鼠的糖代谢紊乱,为孤儿嗅觉受体的配体开发提供了新方法。值得注意的是,人源和鼠源嗅觉受体的同源性通常较低,在表达模式、配体识别和生理功能等方面或存在差异,因此在真正临床应用之前需要对受体功能和配体安全性进行全面评估。
总结
嗅觉受体在糖代谢组织中广泛表达,具备成为代谢性疾病治疗新型药物靶点的潜力,但对其表达模式、生理功能和信号转导机制的了解,以及靶向配体的研究尚在起始阶段。在未来的研究中,可以综合利用时空多组学、结构生物学、人工智能等技术,精准解析其表达模式,揭示受体激活和配体识别机制,阐明嗅觉受体在糖代谢中的调控机制,针对性设计特异性配体,从而充分开发其治疗代谢性疾病的潜力,实现精准治疗。
本文参考文献(上线划动查看)
1. Buck, L., & Axel, R. A novel multigene family may encode odorant receptors: a molecular basis for odor recognition.Cell,65(1),175–187. doi.org/10.1016/0092-8674(91)90418-x (1991).
2.Lee, S. J., Depoortere, I., & Hatt, H. Therapeutic potential of ectopic olfactory and taste receptors. Nature reviews. Drug discovery,18(2),116–138. doi.org/10.1038/s41573-018-0002-3 (2019).
3. Zhang, S., Li, L., & Li, H. Role of ectopic olfactory receptors in glucose and lipid metabolism. British journal of pharmacology,178(24), 4792–4807. doi.org/10.1111/bph.15666 (2021).
4. Cheng, J. et al. Autonomous sensing of the insulin peptide by an olfactory G protein-coupled receptor modulates glucose metabolism. Cell metabolism, 34(2), 240–255.e10. doi.org/10.1016/j.cmet.2021.12.022 (2022).
5. Li, E. et al. OLFR734 Mediates Glucose Metabolism as a Receptor of Asprosin. Cell metabolism, 30(2), 319–328.e8. doi.org/10.1016/j.cmet.2019.05.022 (2019).
6.Wu, C.et al. The Journal of clinical investigation, 127(11), 4118–4123. doi.org/10.1172/JCI89344 (2017).
7. Shepard, B. D., Koepsell, H., & Pluznick, J. L. Renal olfactory receptor 1393 contributes to the progression of type 2 diabetes in a diet-induced obesity model. American journal of physiology. Renal physiology, 316(2), F372–F381. doi.org/10.1152/ajprenal.00069.2018 (2019).
8. Xu, L. et al. Widespread receptor-driven modulation in peripheral olfactory coding. Science, 368(6487), eaaz5390. doi.org/10.1126/science.aaz5390 (2020).
9. Smith, J. S., Lefkowitz, R. J., & Rajagopal, S. Biased signalling: from simple switches to allosteric microprocessors. Nature reviews. Drug discovery, 17(4), 243–260. doi.org/10.1038/nrd.2017.229 (2018).

论文作者介绍

孙金鹏
教授
孙金鹏,教授,博士生导师,国家杰出青年基金、谈家桢生命科学创新奖获得者,北京大学医学部生理与病理生理系教授,山东大学高等医学研究院常务副院长。孙金鹏教授师从于诺奖得主Robert J. Lefkowitz,长期从事膜受体GPCR的相关研究,聚焦于G蛋白偶联受体的配体发现、信号转导及功能研究,发现了类固醇激素的GPCR受体亚家族,阐明了受体对痒觉和力的感知的机制,发展了多种有疾病治疗前景的GPCR配体,以通讯作者在Nature发表论文5篇,Cell 1篇,在Cell Metab,Nat Chem Biol (2篇),Cell Res (2篇),PNAS (4篇),Nat Comm (6篇)等期刊发表70余篇文章。

于晓
教授
于晓,教授,博士生导师,国家杰出青年基金获得者,山东大学基础医学院副院长。于晓教授长期从事内分泌生理和糖尿病的研究,聚焦于胰岛内分泌组织的细胞间环路和GPCR跨膜信号转导对胰岛稳态的维持,阐明了嗅觉受体Olfr109、胆囊收缩素受体、肾上腺素受体、多巴胺受体和胆汁酸受体对胰岛信号环路的调控作用及其结构基础。同时还建立了化学诱导的体外胰岛扩增的方法,为胰岛体外组织再造治疗糖尿病的再生医学奠定了基础。在 Nature (2篇),Cell,Cell Metab,JCI,Cell Res等杂志发表论文80余篇。
相关论文信息
相关研究发表在Cell Press细胞出版社旗下期刊Trends in Cell Biology,
点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Emerging roles of olfactory receptors in glucose metabolism
▌论文网址:
https://www.cell.com/trends/cellbiol-ogy/fulltext/S0962-8924(22)00215-X
▌DOI:
https://doi.org/10.1016/j.tcb.2022.09.005
