原创 Cell Press CellPress细胞科学

生命科学
Life science
近日,复旦大学附属中山医院任骏教授团队在Cell Press细胞出版社旗下期刊Trends in Pharmacological Sciences上发表了题为“Mitochondrial quality control mechanisms as therapeutic targets in doxorubicin-induced cardiotoxicity”的综述论文。该文系统总结了各类线粒体质量控制(包括自噬/线粒体自噬、线粒体动力学、线粒体生物合成)在阿霉素心脏毒性中的变化规律及作用机制,并深入讨论了靶点线粒体质量控制系统治疗阿霉素心脏毒性的潜在方法。
阿霉素心脏毒性的临床现状及发病机制
阿霉素(doxorubicin,DOX)属于蒽环类药物,是目前临床上常用的一种广谱抗肿瘤药物,对多种恶性肿瘤均有治疗作用(如乳腺癌、淋巴瘤、肉瘤和某些类型的白血病),其作用机制在于与人体DNA发生嵌入作用,从而阻断肿瘤细胞增殖和诱导细胞凋亡。然而,DOX一经开发使用就被发现具有剂量依赖的心脏毒性,包括各种类型的心律失常,心室扩张,最终发展为充血性心力衰竭,这些心脏毒性极大地限制了DOX的临床使用。尽管DOX的使用会导致心脏毒性,但由于没有合适的替代药物,DOX仍然是临床上治疗的常用药物。
当前,DOX心脏毒性的发生机制仍不清楚,主要包括DNA损伤、线粒体功能障碍、氧化应激和各类细胞死亡的共同参与。当前治疗DOX心脏毒性的主要药物包括改变DOX的剂量和给药模式、脂质体阿霉素、右丙亚胺和其他抗氧化剂、治疗心衰的药物(如β受体阻滞剂、ACEI/ARB类药物)。然而,这些药物难以靶向其发病的具体机制通路,并且具有应用局限性。比如,研究表明右丙亚胺可能会增加癌症患者的继发恶性肿瘤风险。因此,深入研究DOX心脏毒性的发病机制和寻找新的治疗靶点非常重要。
线粒体质量控制系统与阿霉素心脏毒性
心肌中含有丰富的线粒体,其生物功能为产生ATP以支持心肌细胞的代谢和功能。线粒体质量控制作为一种内源性保护机制,对于维持线粒体稳态至关重要,其失控会导致心脏功能的严重损害。线粒体质量控制主要通过线粒体自噬、线粒体动力学、线粒体生物合成等方式来维持线粒体完整性和功能(图1)。线粒体自噬由自噬体吞噬受损的线粒体实现,主要包括:PINK1-Parkin通路清除受损和丧失电势的线粒体 ,以及Bnip3、Nix或Fundc1等受体依赖的线粒体自噬 。线粒体动力学,以线粒体分裂和融合的协调行动为特征,来改变形状、大小和数量,以满足细胞的新陈代谢需求。Mfn1和Mfn2可调控线粒体外膜的融合,而Opa1蛋白是一种与线粒体内膜紧密结合的跨膜蛋白,可被加工成短型和长型,两者协调完成线粒体内膜融合,并对稳定线粒体嵴非常重要。而Drp1通过与线粒体外膜上的受体结合启动线粒体分裂。线粒体生物合成是一个严格的调控过程,通过PGC-1α激活Nrf1/2和Tfam等信号分子,驱动线粒体DNA(mitochondrial DNA,mtDNA)的复制和转录,并翻译成蛋白,组装合成为新的线粒体。
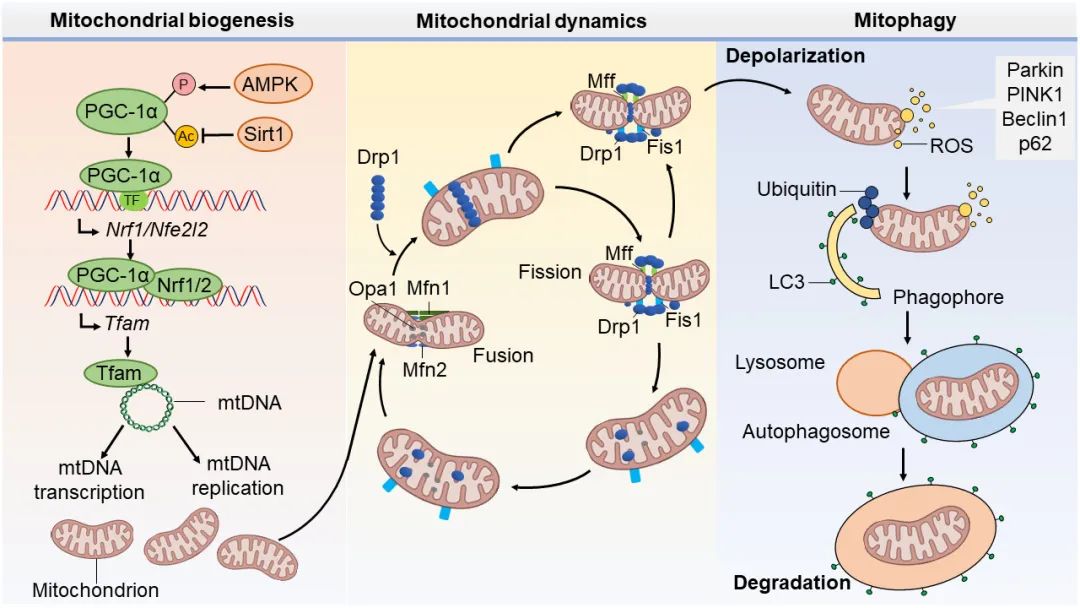
▲图1:心脏中主要的线粒体质量控制机制
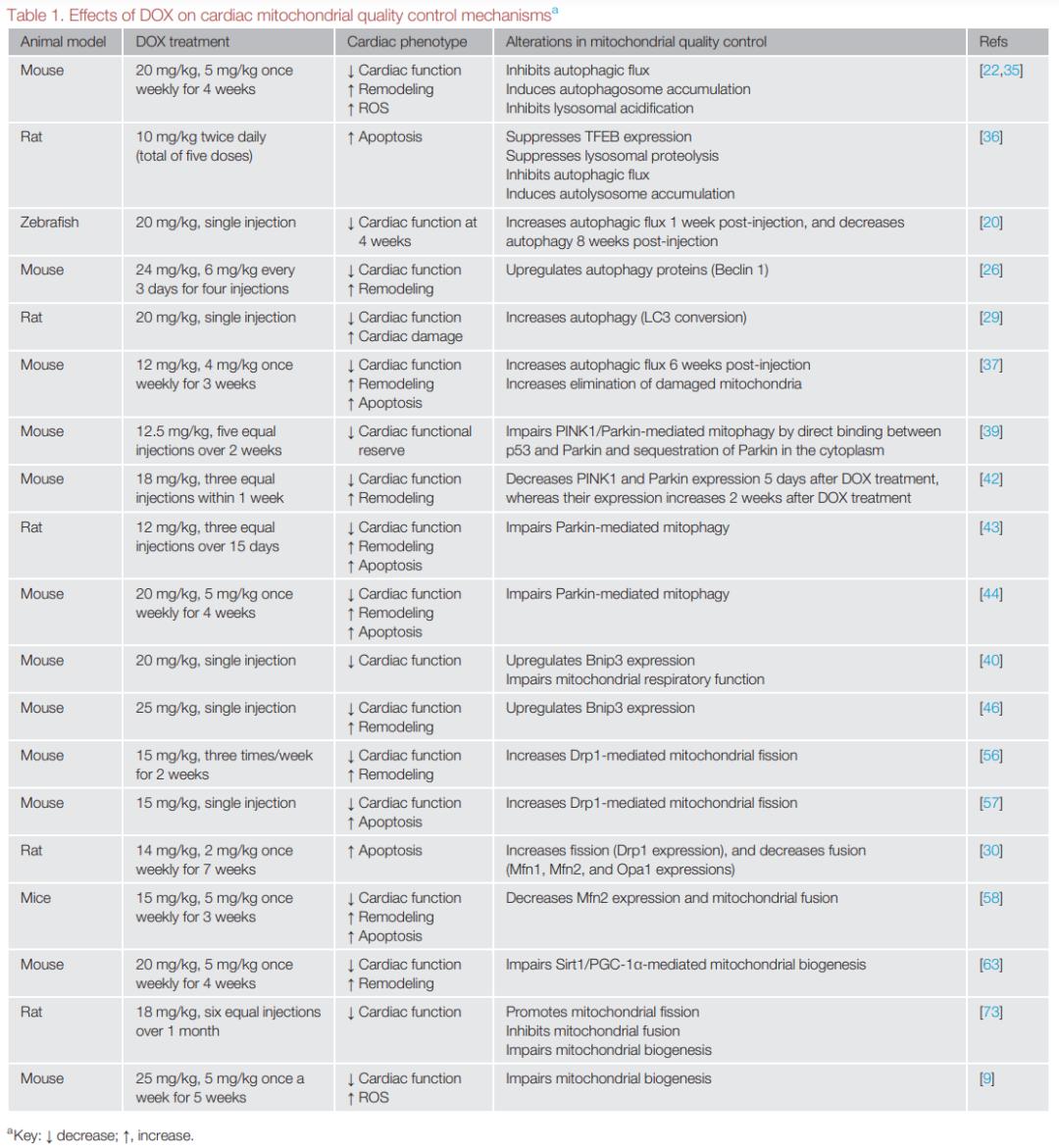
研究表明DOX刺激的心肌细胞表现为线粒体结构和功能异常,并且这些异常与心脏功能受损密切相关。基于心肌细胞对线粒体能量供应的高需求,线粒体质量控制受损能引起和加重线粒体功能障碍。近年来,越来越多证据表明DOX引起广泛的线粒体质量控制失调(表1),这可能作为DOX心脏毒性的主要发病机制。下面着重讨论自噬/线粒体自噬、线粒体动力学和线粒体生物合成在DOX心脏毒性中的作用和机制。
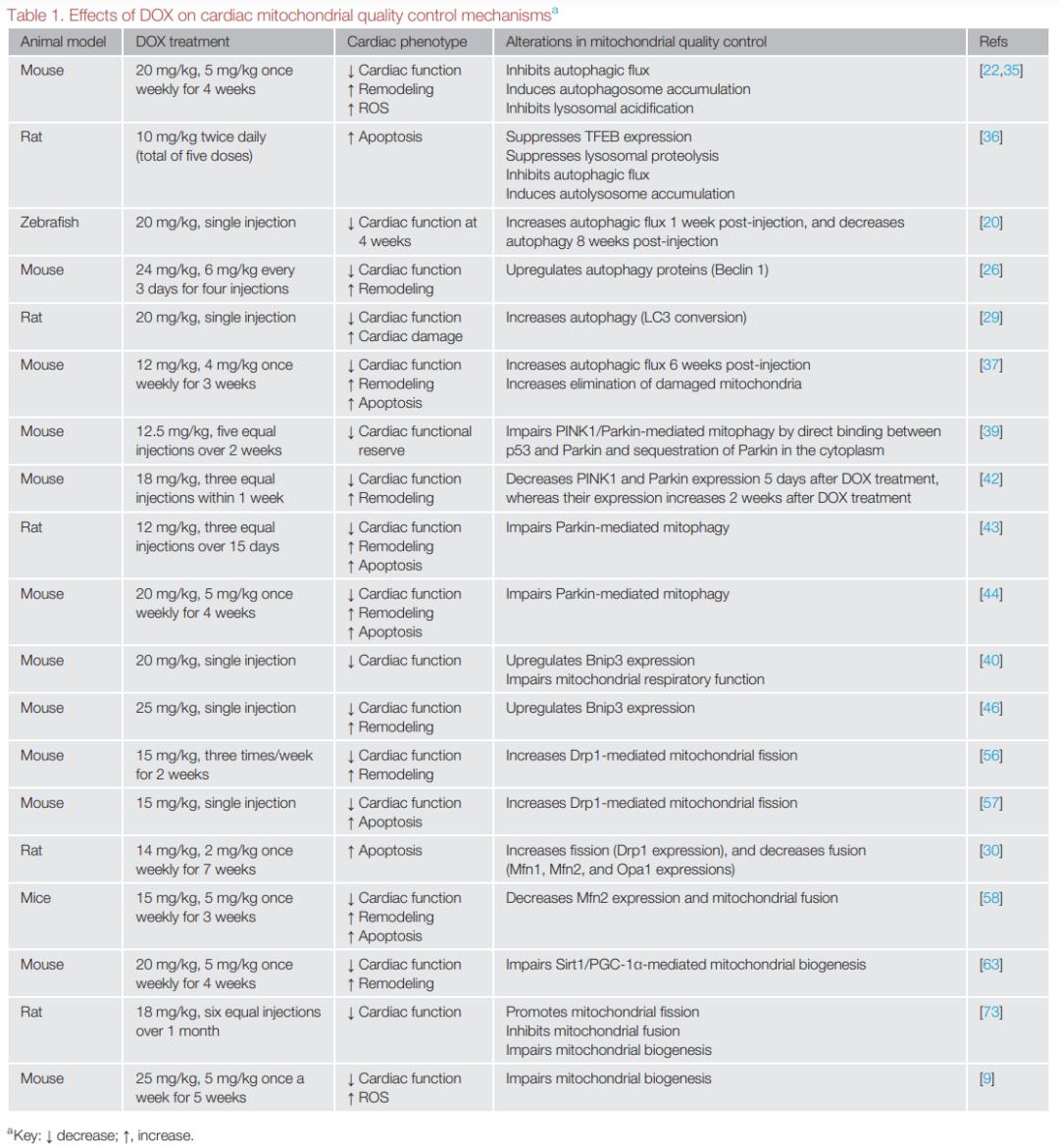
▲表1:DOX对心脏线粒体质量控制的影响
自噬和线粒体自噬在阿霉素心脏毒性中的作用
既往研究表明DOX能引起心肌细胞自噬失调,但目前对于DOX激活还是抑制自噬仍存有争议。近年来一些研究表明DOX先促进自噬启动,然后再通过抑制自噬体和溶酶体融合以及溶酶体酸化来阻断自噬流(图2)。这些作用导致自噬体累积,引发ROS产生和心肌细胞死亡。阻断自噬启动阶段(如杂合敲除Beclin 1)能有效减轻DOX诱导的心脏毒性。机制上,DOX能抑制转录因子TFEB,而TFEB参与调节溶酶体功能和自噬体处理。过表达TFEB或药物激活TFEB能减轻DOX引起的溶酶体功能障碍和ROS产生,进而减少心肌细胞死亡。这些证据表明自噬流受阻是DOX心脏毒性发生的重要机制。
此外,DOX还会引起线粒体自噬功能失调(图2)。研究表明,DOX引起DNA损伤会激活p53,而p53能与Parkin在胞浆结合,阻碍Parkin转位到线粒体外膜,从而抑制PINK1/Parkin介导的线粒体自噬,导致受损的线粒体累积,导致心脏毒性的发生。Parkin敲除会加重线粒体累积和DOX心脏毒性。此外,DOX能激活Bnip3介导的线粒体自噬,导致线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)开放和线粒体去极化,从而引起心肌细胞死亡。当前,DOX对线粒体自噬的调控机制仍不明确,需要更深入的研究
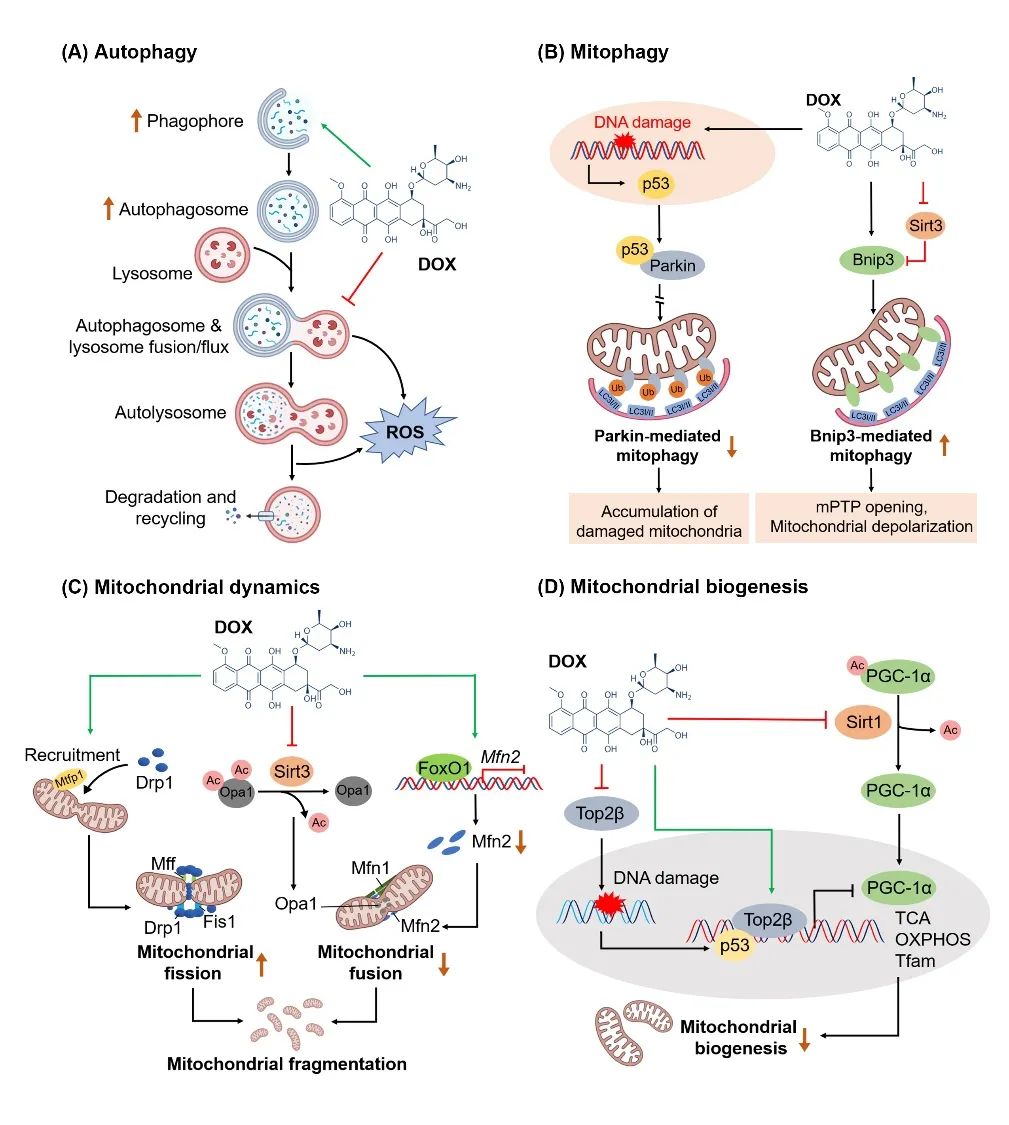
▲图2:DOX对线粒体质量控制系统的影响及机制(A)自噬;(B)线粒体自噬;(C)线粒体动力学;(D)线粒体生物合成
线粒体动力学在阿霉素心脏毒性中的作用
越来越多的证据表明,DOX促进心肌细胞线粒体分裂(上调Drp1表达),抑制线粒体融合(下调Mfn1、Mfn2和Opa1表达),从而导致线粒体碎片化(图2)。此外DOX还能增加Drp1的616丝氨酸位点磷酸化来促进线粒体分裂。据此,Drp1杂合敲除能显著改善DOX心脏毒性。同理,过表达Mfn2能恢复促进线粒体融合,进而减轻DOX心脏毒性。这些证据均表明抑制线粒体分裂或促进线粒体融合能作为治疗DOX心脏毒性的潜在方法。
线粒体生物合成在阿霉素心脏毒性中的作用
研究表明,DOX能下调PGC-1α以及下游相关蛋白(Nrf1、Nrf2和Tfam)的表达,从而抑制线粒体生物合成。机制上,DOX能促进DNA损伤,引起p53激活,促进p53与PGC-1α和PGC-1β的启动子结合,抑制PGC-1α和PGC-1β表达。DOX还能促进Top2β蛋白与PGC-1α和PGC-1β的启动子结合,发挥与p53类似的作用来抑制PGC-1α和PGC-1β表达。此外,DOX能抑制Sirt1,减少Sirt1对PGC-1α的去乙酰化修饰激活。这些机制从转录水平和翻译后修饰水平抑制了PGC-1α的线粒体生物合成功能。由此,受损的线粒体生物合成加重了DOX诱导的线粒体功能障碍和心衰。
靶向线粒体质量控制治疗阿霉素心脏毒性
基于DOX对线粒体质量控制的广泛影响,靶向线粒体质量控制也许能作为治疗DOX心脏毒性的有效方法。当前,一些药物被发现能调控这些质量控制机制,如参与调控自噬或线粒体自噬、抑制线粒体分裂、促进线粒体融合、促进线粒体生物合成,这些方法有望成为治疗DOX心脏毒性打开新的思路。表2总结了当前通过调控线粒体质量控制机制来治疗DOX心脏毒性的药物。
▲表2:调控线粒体质量控制治疗DOX心脏毒性的药物
总结与展望
综上所述,DOX显著影响了心脏线粒体质量控制系统,这加重了心脏中线粒体功能障碍,导致心肌细胞死亡和DOX心脏毒性。线粒体质量控制系统受损被认为是DOX心脏毒性的重要发病机制,临床前研究也表明通过调控这一机制将有效治疗DOX心脏毒性。
在当前,还有一些问题值得进一步深入研究。首先,这些质量控制机制之前的相互作用尚不清楚。其次,大多数研究都是探究DOX对心肌细胞中的线粒体稳态机制,但DOX对心脏中其他细胞类型(如心脏祖细胞、内皮细胞、成纤维细胞等)的影响仍不清楚。此外,DOX对一些线粒体质量控制机制的影响仍有矛盾,如DOX对自噬的激活和抑制作用值得更深入的研究。最后,几乎所有当前的证据都处于动物实验阶段,调控线粒体稳态的药物对DOX心脏毒性的影响还需要更多临床研究来验证其有效性和安全性。
复旦大学附属中山医院心内科博士研究生伍林、王立涛、杜煜昕为该论文共同第一作者,张英梅教授为共同作者,任骏教授为论文通讯作者。

论文作者介绍

任骏
教授
任骏教授,复旦大学附属中山医院心内科,博士生导师。以代谢改变,自噬调节和铁死亡为切入点,主要围绕心血管相关危险因素如肥胖、老龄、酗酒、神经退行性病变,胰岛素抵抗和代谢综合征等展开研究,并以此为依据寻找有效的治疗及预防手段。主持过多项美国国家生命科学基金项目,多项中国国家科技部及自然科学基金。以第一或通讯作者在Nature Rev Endocrinol,Nature Rev Cardiol, Circulation, Sci Adv, Physiological Rev, JACC, Eur. Heart J等杂志发文600余篇,引用46000余次,Clarivate 高被引学者;全球顶尖科学家排名4000;主编3本英文专著,2项美国专利。
相关论文信息
相关研究发表在Cell Press细胞出版社旗下期刊Trends in Pharmacological Sciences
▌论文标题:
Mitochondrial quality control mechanisms as therapeutic targets in doxorubicin-induced cardiotoxicity
▌论文网址:
https://www.cell.com/trends/pharmacologic-alsciences/fulltext/S0165-6147(22)00229-2
▌DOI:
https://doi.org/10.1016/j.tips.2022.10.003
