原创 伍姗姗 储楚 刘妍 细胞世界
脑科学是研究脑的结构与功能的科学,这是21世纪最具挑战性的重大科学领域。大脑是人体中最复杂的器官,数百年来,确定人类大脑发育和神经系统疾病的奥秘一直是医学研究中一个令人着迷的挑战。科学界也在这个问题上付出了巨大的努力,先后建立了各种体内和体外模型,例如细胞模型和动物模型,用于生命和医学研究,大大提高了人们对人脑生理和病理过程的认识。人们常说,人类之所以不同于其他物种,是因为拥有更聪明的大脑,然而,我们至今仍不清楚,这样一个与众不同的大脑,究竟是怎样发育,并最终进化而来的?
在常见的科学研究中,研究者们会使用大家熟悉的模式动物来探索一些脑科学问题,这在一定程度上为了解人脑发育以及神经系统疾病奠定了重要基础。但由于物种的不同,导致这些实验结果可能并不完全适用于人类大脑,这可能也是一些基础向临床转化失败的原因之一。这不免提示我们,除了模式动物以外,人源性脑模型对于研究人类大脑非常重要。科学家们也试图利用2D方法培养人脑神经元,来解析一些神经系统疾病的发生机制,然而不可忽视的是,在培养皿中生长的人脑神经元,无论是空间结构,还是细胞类型的复杂程度、细胞之间的互作以及微环境等,与3D真实人脑相比,2D细胞模型都相差甚远。
随着科学技术的发展,科学家们正在通过发展人脑类器官技术来试图解决这些问题。人脑类器官(brain organoid)是人多能干细胞(hPSC)在体外经诱导分化自发形成的,具有多种细胞构成的器官样组织,该模型在结构和功能上较为真实地还原了人类大脑组织的生理及病理特征;且患者来源的诱导多能干细胞(iPSC)分化的人脑类器官携带有患者的遗传信息,可作为研究人类特有脑疾病机制的优良模型,在生物医学及药物临床前测试中均具有广阔前景。
人脑类器官技术的迅速发展
对于类器官技术而言,干细胞技术的发展是一个非常重要的基础。随着对多能干细胞研究的日益加深,3D类器官的培养技术逐渐成熟起来。而人脑类器官的培育,最早是2008年来自日本的科学家Yoshiki Sasai团队发现来源于干细胞自发组织的神经球中,可以产生皮层样结构,并包含有皮层祖细胞和功能神经元1。到2013年,Lancaster研究团队利用matrigel—一种生物凝胶,来模拟发育中大脑周围的组织,并使用旋转生物反应器来帮助营养的吸收和氧气的扩散,同时在这样持续的3D悬浮培养中添加用于神经发育的生长因子,获得了更复杂的细胞组成和结构2。这也是第一次正式提出3D人脑类器官的概念。此后近十年,人脑类器官进入了迅速发展的阶段。
来自世界各国的科学家们,通过不同的小分子和生长因子组合,将来源于hPSC的人脑类器官向不同脑区诱导,并成功得到了区域特异性的人脑类器官,包括了中脑、海马、丘脑、小脑、纹状体等。除了这些化学因素外,研究者们也通过设计合成不同的生物材料,来引导人脑类器官的形成。比如不同规格的多孔旋转生物反应器,可以减少培养基消耗的同时提高类器官的产量;又比如利用聚合物形成的微丝作为类器官生长的支架,以便形成更大的神经上皮结构。人脑类器官与生物材料的结合,至今仍在不断地摸索与前进中。
大脑分区的结构特性也给了研究者们新的想法。既然人们已经在体外得到了不同脑区的人脑类器官,那么是否可以通过将两个乃至多个脑区的类器官组装在一起,进而模拟真实情况下人类大脑发育、神经元迁移及投射呢?带着这样的思考,2017年有多个研究小组同时进行了这样的探索,他们将背侧前脑与腹侧前脑进行组装,并观察到由腹侧产生的中间神经元会向背侧迁移,并产生类似于体内大脑皮层的切向前移3-5。随后不久,研究者们将丘脑类器官与皮层类器官融合,用以模拟丘脑-皮层之间的神经元双向投射6。现有的工作中,也已经有了将人脑类器官与肌肉组织等非神经类器官进行组装,来观察神经对其他组织结构的支配效应,并得到了与人体内相似的结果7。如今,这种结合不同细胞谱系的多区域类器官也被称为“类组装体”(assembloid)。
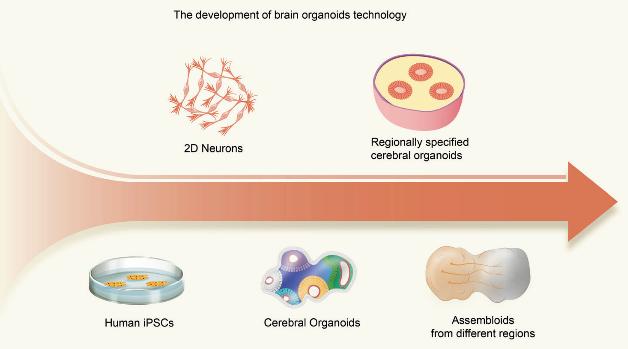
图1 人脑类器官的主要技术发展8
人脑类器官的应用
自从人脑类器官技术诞生以来,它们在各种研究学科和医学探索中都得到了广泛的应用,并且拥有着强大的潜力。
人脑类器官的一大应用是模拟大脑发育,其中因为巨大的物种差异让人类的大脑皮层成为最独特的区域,而使得皮层类器官成为该领域研究最多的一种。通过单细胞转录组测序分析,研究者们发现所培育出的皮层类器官类似于人类在妊娠早期和中期发育的胚胎皮层。同时更让人信服的是,在皮层类器官中,人们可以观察到明显的皮层分层结构,包括人类独特拥有的细胞类型外侧放射状胶质细胞(ORG),以及主要由该细胞类型组成的区域外侧室管膜下区(OSVZ),这是动物模型所不具备的优势,也让人脑类器官成为研究人类大脑发育的模型。
而源于患者的iPSC所构建的人脑类器官,则会携带有患者的遗传信息,这无疑是用于研究人类神经系统疾病的有力工具。此外,由于体外培育的可操作性与方便性,可以通过基因编辑等技术对正常hPSC进行干预,从而达到疾病模拟或挽救的效果,这也是类器官技术带给研究者们的便捷。2021年的一项研究探究了唐氏综合征患者来源的人脑类器官存在皮层发育缺陷,而通过干预DSCAM基因表达及抑制下游分子PAK1可挽救该发育缺陷9。通过这种方式,体外诱导的人脑类器官不仅可以用于探究疾病,更可以成为疾病治疗方案筛选的良好工具,这也为研究神经系统疾的研究者们提供了人源化的模型。
此外,来源于hPSC的人脑类器官为个体化医疗提供了有前景的平台,而体外培养的人脑类器官可以长期供给的这一特征,又为类器官移植提供了潜在的解决方案。为了使人脑类器官移植成为现实,研究人员做了很多努力来验证其可行性。早在2018年,刘妍课题组就试图将患者来源的GABA能神经祖细胞移植入免疫缺陷小鼠脑中,并发现移植的人类神经祖细胞可以存活并在4-6月后成熟且形成跨脑区投射和突触连接10。在该技术基础上,2020年该课题组将人脑类器官移植入小鼠的内侧前额叶皮层,观察到人脑类器官得以良好的存活,并建立了长距离皮层下跨脑区投射,同时可与宿主小鼠形成双向突触连接11。最近来自斯坦福大学的一项研究,将人脑类器官移植入大鼠的感觉皮层中,同样发现其可以在大鼠脑中正常生长,并参与大脑控制行为的神经环路12。器官移植是治疗器官衰竭不可或缺的资源,虽然至今仍存在许多挑战,但理论上说,未来干细胞以及类器官技术将使得每个个体可以利用自身细胞通过诱导分化得到个体特异的器官组织,从而减少如今移植治疗中严重的免疫排斥反应和器官供体的短缺问题。当然,这还有很长的路要走,而上述这些研究都为将来的器官移植治疗奠定了理论与实践基础。
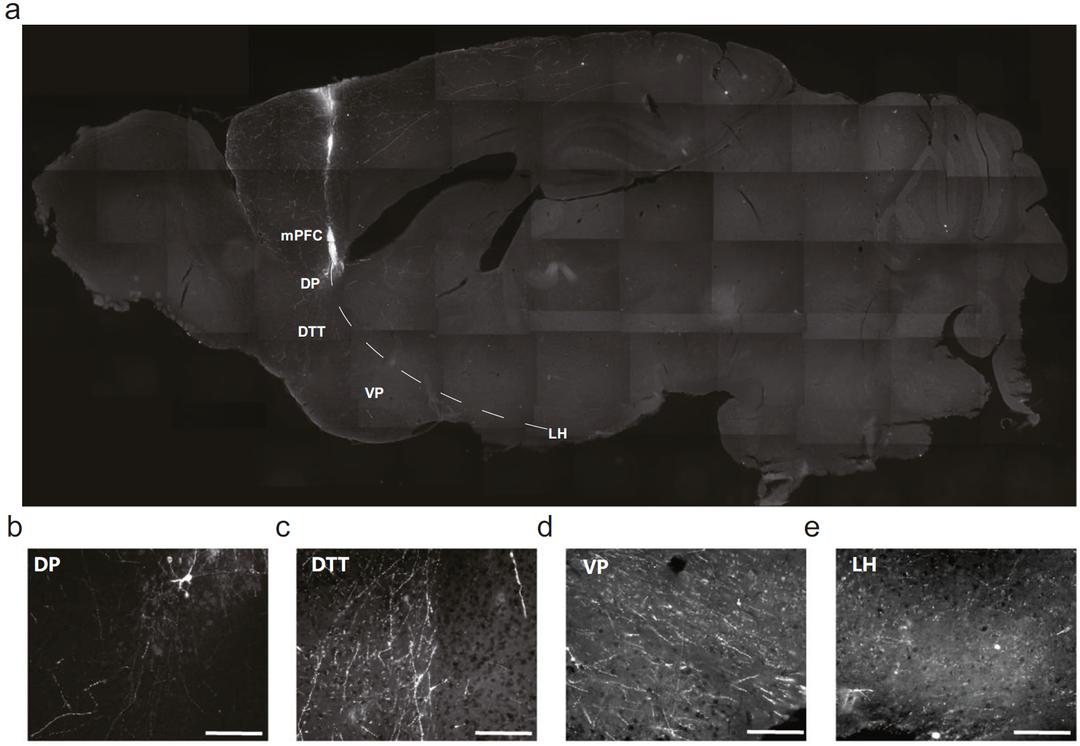
图2 人脑类器官移植后整合入宿主并发生皮层下脑区投射11
另一方面,应用人脑类器官研究人类进化过程是近年来全新的研究方向。我们知道,就计算能力而言,人类大脑远远超过了动物王国里的任何动物,它使我们与众不同,但我们仍然不明白它是如何产生的。让我们大脑如此特别的原因之一是神经元的数量,人类大脑拥有800-1000亿个神经元,大约是我们的近亲黑猩猩的三倍。因此有人认为,在人类大脑发育过程中神经元发生过程中存在激增的阶段,但这是何时以及如何发生的?带着这样的疑问,科学家们构建了黑猩猩、猕猴和人脑类器官,通过对比不同物种脑类器官中发育相关基因,他们解析出一些人类特异性基因表达变化情况,并且明确了在发育不同时段人类大脑中细胞状态特异性变化,这些发现为进一步探究人类在进化过程中与其他灵长类区分的基因调控机制提供了依据13。而为了研究现代人类特有的遗传变异,2021年美国研究人员将现代人类NOVA1基因的等位基因替换为在古人类尼安德特人和丹尼索瓦人中发现的原始等位基因,发现该基因的特异性变化对物种进化产生显著影响,这项发现也拉开了直接在人脑类器官细胞中研究古人类遗传和进化的序幕14。
无论是基础研究还是临床实验,人脑类器官有着巨大的应用前景,而它更广泛的应用正处于探索的开始阶段,来自各国的研究者们也将为此努力做出贡献。
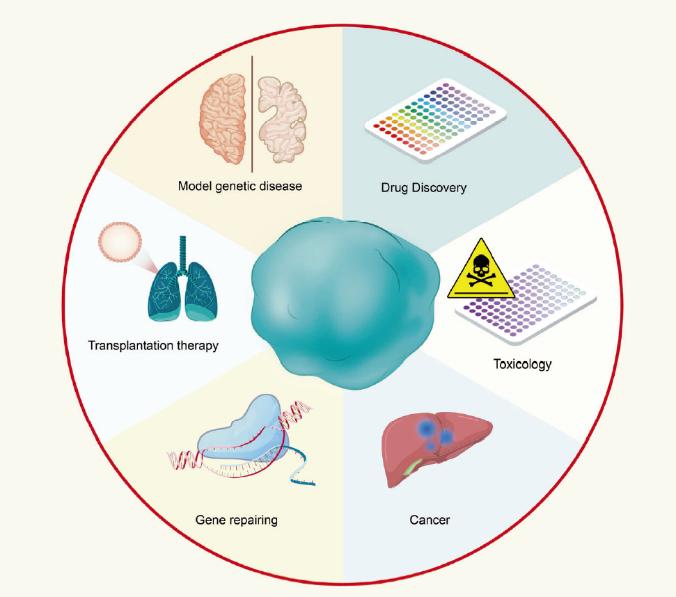
图3 类器官的广泛应用8
类器官研究展望:认识不足,面向未来
我们时常感叹科幻电影中人工智能的不可思议,然而随着科学技术的进步,也许以后这不再仅仅是电影中炫酷的画面。最新研究中,人脑神经元与人工智能的结合并成功学会乒乓球游戏这一结果的发现15,为人脑类器官应用于探索脑-机接口、记忆及意识等前沿问题提供了可能,相信未来科研人员会进一步深入探究人脑类器官与生物芯片、人工智能之间的正确定位。
尽管人脑类器官技术正在飞速向前发展,我们仍不可忽视该领域中存在的诸多问题。虽然研究者们对类器官技术进行不断更新改良,但人脑类器官与真实人脑之间的差距依旧存在,此为领域内公认的重要科学难题。目前人脑类器官在结构和功能上还远不如真实脑组织复杂,如二者之间尺寸大小的差异、体外培养的人脑类器官缺乏功能性的血管、缺乏神经免疫细胞等。种种问题仍需要科研人员持续的探索,我们也相信,在不久的将来,在全世界科学家们的努力下,终将有解决的方法,从而真正地构建出无限接近真实人脑的人脑类器官,并得以从中找出是什么让我们的大脑如此独特这个问题的根源。
撰稿人
伍姗姗(南京医科大学生殖医学国家重点实验/博士研究生),储楚(南京医科大学药学院干细胞与神经再生研究所/硕士研究生),刘妍(南京医科大学药学院干细胞与神经再生研究所/教授,博士生导师)
参考文献
1.Eiraku, M. et al. Self-organized formation of polarized cortical tissues from ESCs and its active manipulation by extrinsic signals. Cell stem cell 3, 519-532, doi:10.1016/j.stem.2008.09.002 (2008).
2.Lancaster, M. A. et al. Cerebral organoids model human brain development and microcephaly. Nature 501, 373-379, doi:10.1038/nature12517 (2013).
3.Bagley, J. A., Reumann, D., Bian, S., Lévi-Strauss, J. & Knoblich, J. A. Fused cerebral organoids model interactions between brain regions. Nature methods 14, 743-751, doi:10.1038/nmeth.4304 (2017).
4.Birey, F. et al. Assembly of functionally integrated human forebrain spheroids. Nature 545, 54-59, doi:10.1038/nature22330 (2017).
5.Xiang, Y. et al. Fusion of Regionally Specified hPSC-Derived Organoids Models Human Brain Development and Interneuron Migration. Cell stem cell 21, 383-398.e387, doi:10.1016/j.stem.2017.07.007 (2017).
6.Xiang, Y. et al. hESC-Derived Thalamic Organoids Form Reciprocal Projections When Fused with Cortical Organoids. Cell stem cell 24, 487-497.e487, doi:10.1016/j.stem.2018.12.015 (2019).
7.Andersen, J. et al. Generation of Functional Human 3D Cortico-Motor Assembloids. Cell 183, 1913-1929.e1926, doi:10.1016/j.cell.2020.11.017 (2020).
8.Tang, X. Y. et al. Human organoids in basic research and clinical applications. Signal transduction and targeted therapy 7, 168, doi:10.1038/s41392-022-01024-9 (2022).
9.Tang, X. Y. et al. DSCAM/PAK1 pathway suppression reverses neurogenesis deficits in iPSC-derived cerebral organoids from patients with Down syndrome. The Journal of clinical investigation 131, doi:10.1172/jci135763 (2021).
10.Huo, H. Q. et al. Modeling Down Syndrome with Patient iPSCs Reveals Cellular and Migration Deficits of GABAergic Neurons. Stem cell reports 10, 1251-1266, doi:10.1016/j.stemcr.2018.02.001 (2018).
11.Dong, X. et al. Human cerebral organoids establish subcortical projections in the mouse brain after transplantation. Molecular psychiatry 26, 2964-2976, doi:10.1038/s41380-020-00910-4 (2021).
12.Revah, O. et al. Maturation and circuit integration of transplanted human cortical organoids. Nature 610, 319-326, doi:10.1038/s41586-022-05277-w (2022).
13.Pollen, A. A. et al. Establishing Cerebral Organoids as Models of Human-Specific Brain Evolution. Cell 176, 743-756.e717, doi:10.1016/j.cell.2019.01.017 (2019).
14.Trujillo, C. A. et al. Reintroduction of the archaic variant of NOVA1 in cortical organoids alters neurodevelopment. Science (New York, N.Y.) 371, doi:10.1126/science.aax2537 (2021).
15.Kagan, B. J. et al. In vitro neurons learn and exhibit sentience when embodied in a simulated game-world. Neuron, doi:10.1016/j.neuron.2022.09.001 (2022).
相关阅读
原标题:《【科学普及】如何在体外构建人类大脑?——人脑类器官带来的机遇与挑战》
