以下文章来源于生物化学与生物物理进展 ,作者PIBB
生物化学与生物物理进展.
期刊宣传、为作者和审稿人提供移动终端的登录服务
作者 | 许兰 任立成
责编 | 霍麟
染色质的“变身”过程——谁还没有两幅面孔了!
染色质作为遗传信息的载体,储存于细胞核中。对于人类细胞而言,一个细胞核中的DNA分子总长约为2 m,而细胞核的直径仅为5~10 μm。所以,必然存在一种机制把特别长的DNA分子装进肉眼不可见的细胞里。染色质由DNA、组蛋白和非组蛋白等成分组成并凝聚成一条染色体(宽约1400 nm)。浓缩的染色质(直径约700 nm)则由更细的染色质纤维(直径300 nm)和核小体(直径30 nm)组成。核小体是染色质的核心结构元件,由4种核心组蛋白H2A、H2B、H3和H4各两分子组成一个球状蛋白八聚体,周围缠绕着约147 bp的DNA(直径2 nm)。显然,这种盘绕方式不足以把2 m长的DNA塞进细胞核。于是,核小体串珠结构又被进一步折叠缠绕形成长为2~10 μm的染色单体(图1),使其可以塞进细胞核。在这个过程中,DNA分子的长度共被压缩了8000~10000倍[1-2]。
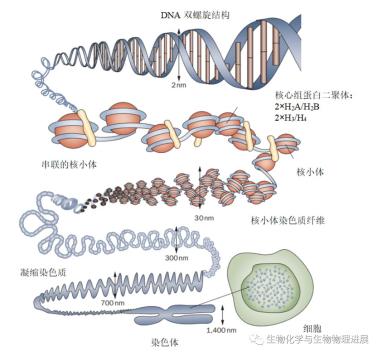
图1 染色质在细胞内的组织[1]
蛋白质的结合之门——开放染色质区
细胞核的内部是一个高频动态的体系,大多数染色质以直径为30 nm染色质纤维的形式存在。这是在核小体串珠结构的基础上螺旋化而成的结构形式。核小体在整个基因组上的分布是不均匀的。核小体结构致密的区域,其与基因表达相关的结构区域相对封闭,不利于转录因子等调控元件与之结合,从而导致基因沉默;而核小体分布较少的区域,允许转录调控元件与这些区域的启动子、增强子相互接近并结合,进而调控基因表达(图2)[3]。因此,染色质DNA在行使转录以及复制合成的功能过程中,蛋白质需要脱离DNA,使其处于裸露状态,即折叠结构变成松散状态时,这种裸露的DNA便于启动转录以调控基因的表达。
这种允许启动子、增强子、绝缘子、沉默子等顺式调控元件和反式作用因子能够与染色质DNA物理接触的程度就称为染色质可及性(Chromatin Accessibility),由核小体的占有率和拓扑结构以及其他阻碍DNA结合的染色质结合因子决定。简而言之,染色质可及性就是指染色质的物理压缩程度。这个过程类似于将一份压缩文件(封闭染色质)进行解压(开放染色质)后才能看到具体的文件内容。
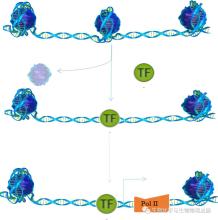
图2 染色质可及性的动态变化
TF, 转录因子(transcription factor); Pol Ⅱ, RNA聚合酶Ⅱ
叩开与蛋白质结合之门
为了研究在不同的细胞生物进程中染色质的结构与其功能之间的关系,就需要对活跃的开放区域进行分析。目前研究染色质可及性的方法主要是将酶切法或物理化学方法与下一代测序技术结合,检测染色质开放或受保护的区域。常用的方法有脱氧核糖核酸酶I超敏位点测序(DNaseI hypersensitive site sequencing,DNase-seq)、微球菌核酸酶测序(micrococcal nuclease sequencing,MNase-seq)、甲醛辅助分离调控元件测序(formaldehyde-assisted isolation of regulatory elements sequencing,FAIREseq)以及转座酶可及性测序(assay for targeting accessible-chromatin with high-throughout sequencing,ATAC-seq)(图3)。
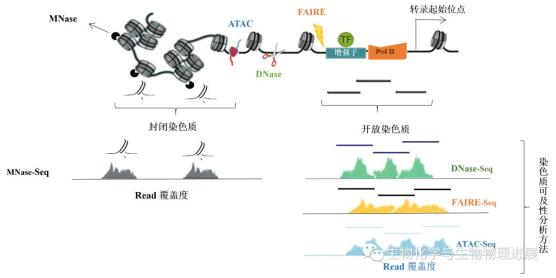
图3 检测染色质可及性和核小体定位的实验方法
01
MNase-seq
利用MNase消化核小体之间裸露的DNA区域,从染色质中释放出核小体,然后富集与核小体结合的DNA片段并测序。绘制核小体的位置图谱,从而间接反应出染色质的可及性区域。
02
DNase-seq
利用核酸内切酶DNase I对基因组DNA进行非特异性的消化和切割,而与核小体结合的DNA序列不会被DNase I切割,正是因为这个特点,通过确定DNase I消化后留下的DNA片段,就能够获得开放染色质的信息。
03
FAIRE-seq
基因组DNA通过交联剂甲醛共价结合到染色质蛋白质上,利用超声波将染色质剪切成碎片,苯酚-氯仿抽取后,缠绕有DNA的核小体分布于两相交界处,而无核小体的DNA则分布于水相中。对水相中的DNA进行测序分析,就可以确定开放染色质区域。
04
ATAC-seq
使用了一个预先装载DNA接头的Tn5转座酶,旨在对基因组进行酶切的同时标记被剪切的DNA片段。由于空间位阻,大多数的DNA标签序列被整合到染色质开放区域。是近年来分析全基因组染色质可及性首选的技术方法。
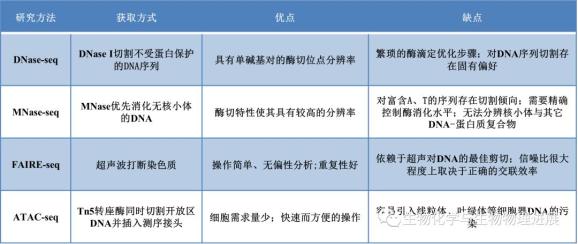
以上4种方法中,除FAIRE-seq是使用超声波物理破碎基因组DNA外,MNase-seq、DNase-seq和ATAC-seq都是基于不同的酶对DNA片段进行切割;MNase-seq直接检测与核小体结合的DNA序列,绘制出核小体占据图,从而间接反映出染色质的可及性区域,另外3种方法则直接检测染色质开放区域。每一种分析方法各有其优点和局限性(见下表)。这些方法通常反映了多个细胞的平均状态,无法分析群体细胞之间出现的差异,为了解决这一问题,科学家们开发出了单细胞scDNase-seq、scMNase-seq和scATAC-seq分析技术。在同一单细胞上同时进行多组学的联合分析在疾病研究和理解基因组功能领域上具有广阔的应用前景。
研究染色质可及性的意义
基因的表达调控可以通过改变染色质的拓扑结构或染色质修饰来实现。当组蛋白和DNA之间的结合力增加时,染色质浓缩成闭合构象并阻止转录因子进入DNA,导致基因抑制。相反,当组蛋白与DNA之间的结合力降低时,染色质解聚形成“开放”构象,使转录因子可接近DNA,从而导致转录激活。随着组织形态和功能的发展,细胞的表观遗传状态和基因表达谱发生动态变化,并随着环境的变化而不断变化,调节与形态发生和谱系指定相关的基因表达。染色质这种动态的重塑变化与胚胎发育、细胞衰老、肿瘤 发生、免疫、细胞命运决定过程密切相关[4-6]。此外,染色质的动态结构还和人类健康有关。在全基因组层面对染色质可及性有了全局的认识后,就可以破译基因转录调控中的有效调控元件,为深入认识疾病的致病机制提供新的思路。(详情请点击下方阅读原文)
参考文献
[1] Tonna S, El-Osta A, Cooper M E, et al. Metabolic memory and diabetic nephropathy: potential role for epigenetic mechanisms. Nat Rev Nephrol, 2010, 6(6):332-341
[2] Klemm S L, Shipony Z, Greenleaf W J. Chromatin accessibility and the regulatory epigenome. Nat Rev Genet, 2019, 20(4):207-220
[3] Minnoye L, Marinov G K, Krausgruber T, et al. Chromatinaccessibility profiling methods. Nat Rev Methods Primers, 2021, 1(1):1-24
[4] Lee J H, Kim E W, Croteau D L, et al. Heterochromatin: anepigenetic point of view in aging. Exp Mol Med, 2020, 52(9):1466-1474
[5] 江小霞,王常勇. 表观遗传学与组织工程. 生命科学, 2020, 32(3):299-307[6] Nemec S, Kilian K A. Materials control of the epigeneticsunderlying cell plasticity. Nat Rev Mater, 2020, 6(1):69-83
作者简介
许兰,海南医学院细胞生物学专业在读硕士研究生。
研究方向为细胞分化与表观遗传。


作者简介
任立成,博士,研究员,海南医学院生物学教研室主任。
主要从事干细胞、肿瘤细胞在诱导增殖分化过程中,染色质重塑及其表观遗传学机制的研究。
本文转载自公众号“生物化学与生物物理进展”
原标题:《【前沿科普】染色质可及性:探索功能基因组的窗口》
