近日,同济大学附属东方医院及附属同济医院的联合研究团队在 Nature Communications 期刊在线发表了题为:Dual functions of microRNA-17 in maintaining cartilage homeostasis and protection against osteoarthritis 的研究论文。
该研究发现了骨关节炎新的发病机制,报道了微小RNA-17(miR-17)通过抑制缺氧诱导因子HIF-1α和多种基质降解酶,发挥了维持关节软骨生理性更新以及抑制骨关节炎软骨破坏的双重作用,确定了miR-17是骨关节炎诊断、预防和治疗的重要靶点。
骨关节炎是最常见的滑膜关节退行性病变,致残率高,严重影响老年人的生命质量。骨关节炎软骨破坏涉及多种炎症因子和基质降解酶的异常激活,目前没有一种药物能同时靶向多个因子、改善关节软骨的进行性破坏。并且,如何促进软骨的修复再生亦是治疗的难点。MMP13和ADAMTS5是导致软骨降解最重要的两个酶,研究者首先使用生物信息软件预测microRNA-mRNA的作用靶点,筛选出了能同时抑制MMP13和ADAMTS5的若干个微小RNA。其中的miR-17和miR-20a都属于miR-17~92基因簇(可产生6种微小RNA),软骨形态发生蛋白GDF-5可诱导miR-17表达显著上调。既往研究证实了miR-17~92基因簇(特别是miR-17)对人类和小鼠骨骼发育的关键作用,但是它们对成年后的关节软骨稳态和骨关节炎发生发展的影响还未得到深入研究。
此项研究发现miR-17在表层和中层软骨细胞中富集,在早期骨关节炎软骨细胞中即表达减低,人类骨关节炎软骨中miR-17表达下调与软骨破坏具有相关性。软骨细胞特异的miR-17~92缺失小鼠或者关节腔内注射miR-17拮抗剂的小鼠在膝骨关节炎模型中发生更严重且广泛的关节软骨破坏。关节腔内注射外源性的miR-17或者由GDF-5诱导的内源性miR-17上调均能有效减轻骨关节炎的严重程度,阻止关节软骨破坏,miR-17治疗骨关节炎的效果要优于同基因簇的其他微小RNA(图1)。机制研究发现,miR-17结合到病理性分解基因3’-UTR的特异位点,能直接抑制MMP3、MMP13、ADAMTS5和NOS2的表达,具有多靶点的作用,因此miR-17对软骨破坏具有强大而广泛的抑制效果,同时阐明了骨关节炎关键基因GDF-5通过miR-17抑制软骨分解代谢的机制(图2)。
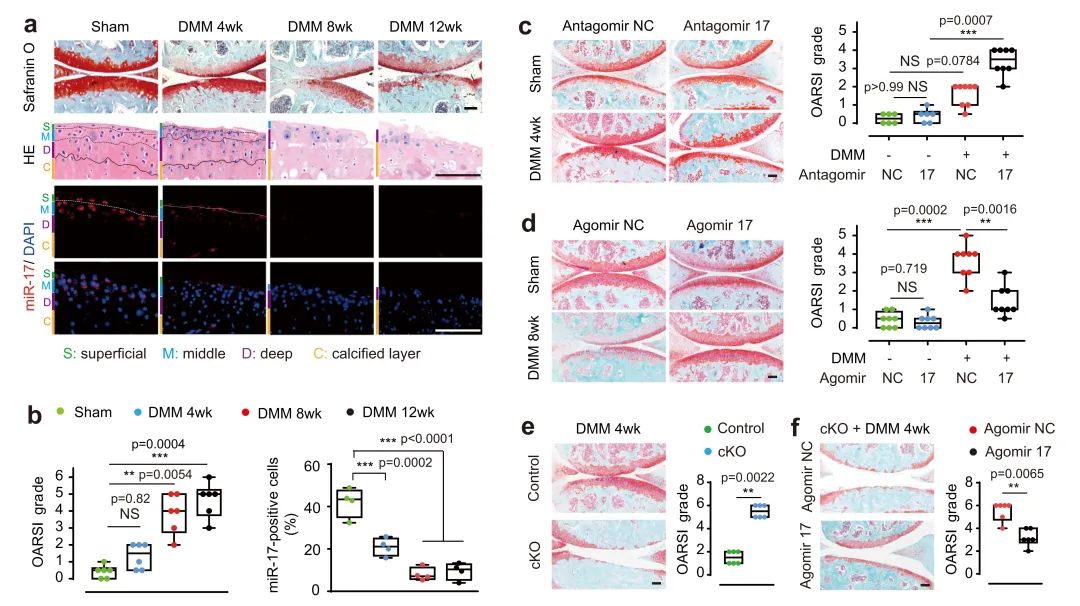
图1、miR-17缺失导致骨关节炎进展加快
研究团队发现miR-17~92敲除小鼠的关节软骨在无外界损伤下发生病变,表层软骨细胞数量减少,软骨基质水肿且疏松,但是不伴有病理性分解基因的上调。研究团队为阐明软骨自发性退变的机理,运用单细胞RNA测序技术并分析发现表层软骨含有两种细胞,其一分泌生理性分解酶(MMP2、MMP14等),以维持软骨组织更新;其二分泌润滑素并呈现关节滑膜内层细胞特征,暗示了与滑膜组织的发育同源性。敲除miR-17~92软骨细胞的合成表型和生理性分解因子的表达均显著下调,关节腔内注射miR-17后能恢复合成和分解因子的稳态水平,维持软骨组织的正常结构,进一步证明了miR-17的核心作用。研究人员对测序数据进行深入分析,发现了若干胶原修饰酶在miR-17~92敲除软骨细胞中表达升高,且这些酶受到HIF-1α蛋白的调控。研究者证实了miR-17~92敲除鼠关节软骨组织中HIF-1α表达显著增强,并通过一系列实验阐明miR-17是软骨细胞中HIF-1α的负向调控因子,miR-17直接靶向并限制HIF-1α的过度表达,以维持细胞正常的代谢水平和软骨组织生理性稳态(图2)。此研究相关发明专利(一种抑制骨关节炎的microRNA及其应用)已于 2019年获得授权。
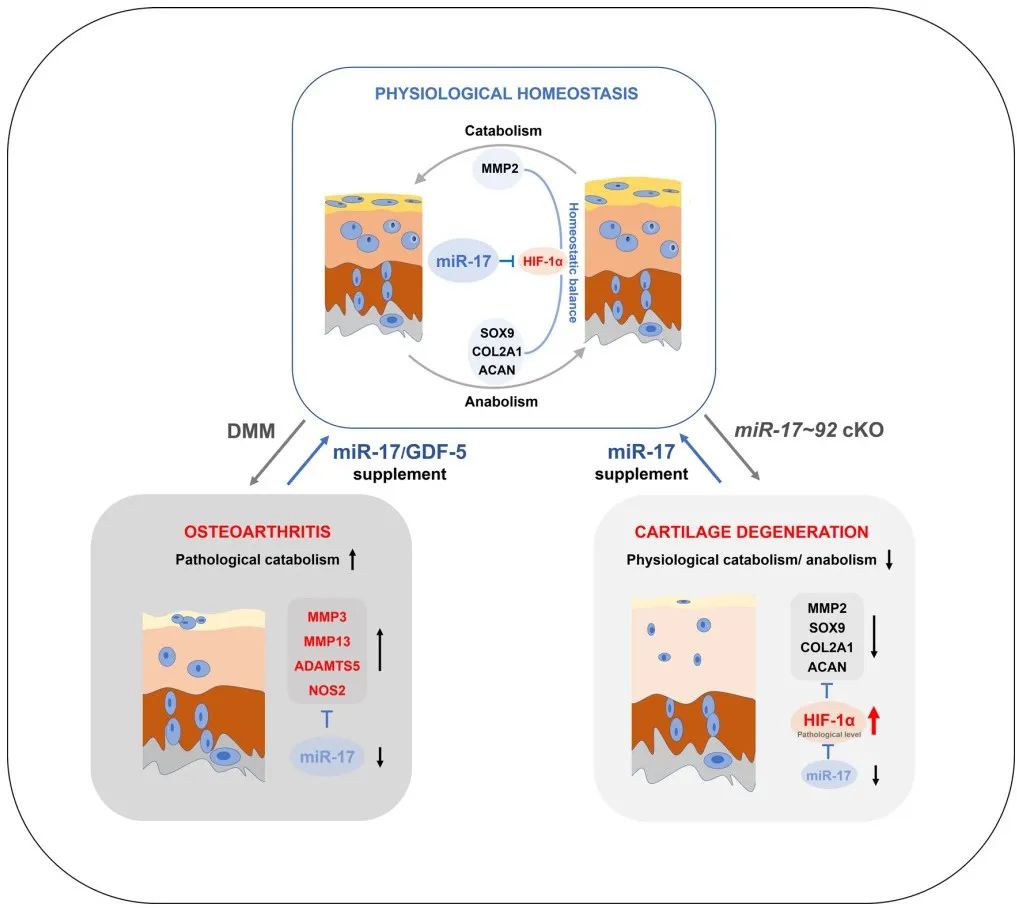
图2、miR-17抑制骨关节炎软骨破坏及维持软骨稳态的机制示意图
同济大学附属同济医院崔磊教授和附属东方医院孙毅教授为论文共同通讯作者。同济大学附属东方医院再生医学研究所张昀助理研究员为论文第一作者。同济大学附属东方医院关节与骨病专科主任尹峰教授为此项研究提供了重要指导。
论文链接:
原标题:《Nature子刊:同济大学崔磊/孙毅合作发现骨关节炎发病新机制》
