原创 果壳硬科技 我是科学家iScientist
对于新冠肺炎的治疗和预防,抗体疗法是目前最主要的治疗手段之一。现在的研究多集中于中和性单克隆抗体(monoclonal antibodies,简称单抗或mAbs)这一类药物。然而对于随着新冠肺炎病毒SARS-CoV-2的不断变异,单纯使用普通单抗已经很难满足抑制Beta、Delta乃至Omicron等突变毒株的需求。
2022年2月28日,中国疾控中心主任高福院士和首都医科大学基础医学院病原生物学系吴燕教授团队在Nature Immunology发表论文[1],研制了一种基于单抗B38和H4的双特异性抗体“bsAb15”。与亲本单抗乃至抗体鸡尾酒策略相比,bsAb15都具有更强的抗病毒活性和抑制逃逸突变能力,是治疗和预防重症新冠肺炎的一种可行而有效的策略,对早期毒株和近期流行的Delta毒株都具有显著的防治效果。
中和抗体与SARS-CoV-2的逃逸突变
当病毒侵入人体之后,免疫细胞会把中和蛋白分泌到血液里,与血液中的病毒颗粒结合并破坏病毒颗粒(“中和”掉了病毒),阻止病毒感染细胞,这即是“中和抗体”。而我们常说的单克隆抗体药物,就是从单一免疫细胞克隆而来的抗体。
对于新冠病毒SARS-CoV-2而言,它感染细胞的关键在于其刺突S蛋白与人体ACE2蛋白的结合。因此,目前中和单抗大多靶向刺突S蛋白的RBD(受体结合域,receptor-binding domain)以阻断其与ACE2的结合[2,3],或是靶向RBD或NTD(N端结构域,N-terminal domain)的非封闭表位[4],并且确实已经投入到了新冠肺炎的临床预防和治疗中。
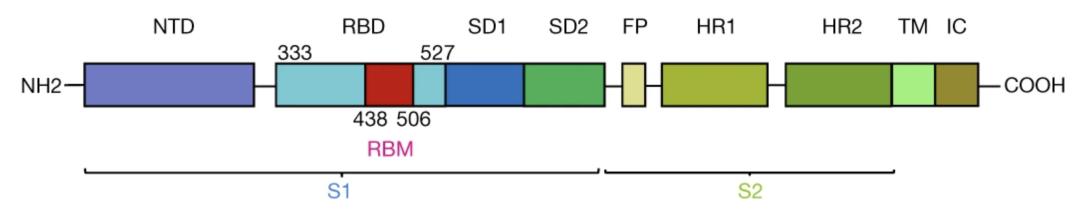
SARS-CoV-2 S蛋白的结构示意 | 参考文献[5]
然而,由于SARS-CoV-2作为RNA病毒自然突变率高的特性,在实际的免疫治疗中,逃逸突变成为了一个严峻的问题——病毒会通过改变自身蛋白序列来逃避抗体的识别。到目前为止,新冠病毒已经产生了SARS-CoV-2 B.1、B.1.1.7(也称为501Y.V1或Alpha变异株)、南非B.1.351变异株(也称为501Y.V2或Beta变异株)、B.1.525、B.1.617.2(Delta变异株)等等变异毒株。它们的变异主要集中在S蛋白的NTD和RBD上,导致许多靶向NTD和RBD的单抗都面临失效。据报道,Delta变种对康复者或疫苗接种者血清中和的抵抗力是原始株的6.8倍[6]。
为了应对病毒逃逸突变的现象,就要求抗体药物能够有更多的“备选”病毒中和位点。一种策略被称为“抗体鸡尾酒”,即使用与S蛋白不同表位结合的抗体的混合物。特朗普患新冠时的治疗策略之一,就是这种鸡尾酒疗法。疫情早期使用恢复期患者血清进行治疗的原理也与之类似。然而,这种策略由于需要同时生产不同的抗体种类,成本和产量都不具优势。
而另一种策略,是将两个单抗的不同结合表位集合到同一个抗体蛋白上,这就是双特异性单克隆抗体(bispecific monoclonal antibody,bsAb),可以通过一个分子靶向两个不同的抗原结合位点。在药物开发中,双特异性抗体通常是比使用单一单抗或抗体鸡尾酒更具成本效益的策略,可以满足由于新冠肺炎相关疫苗和疗法而增加的产能要求。
最新成果:
抗新冠双特异性抗体BsAb15
“双特异性抗体策略在肿瘤和自身免疫性疾病领域已有较多临床研究和应用,但是在传染病治疗领域双特异性抗体研究仍然较少。”论文的共同通讯作者谭曙光副研究员和吴燕教授对果壳介绍道。
先前,团队已从康复者外周血中优选出了两株高亲和性和抗病毒活性的全人源单抗B38和H4,同时还解析了单抗与RBD的晶体结构并阐明了抗体与RBD的互作机制,为抗新冠双特异性抗体药物开发提供了重要的理论基础[7]。
在此次的论文中,基于B38和H4这两种非竞争性结合RBD不同区域的单抗,研究团队进行了不同构型的双特异性抗体改造,并进行体外结合和病毒中和活性的系统比较,优选了具有更高病毒中和活性的单分子四价双特异性抗体bsAb15。
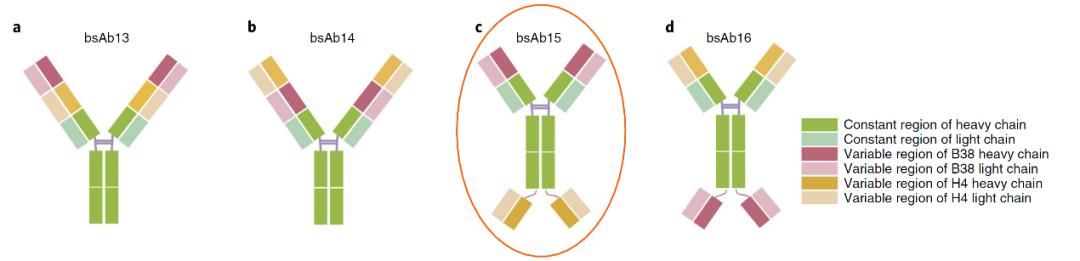
基于单抗B38和H4设计的几种双特异性抗体 | 参考文献[1]
bsAb15采用左右对称的抗体构型,其抗原结合部分分别由全人源的单抗B38 Fab段和H4单抗的单链可变区组成,可以识别SARS-CoV-2表面S蛋白上的RBD的不同表位,一个双特异性抗体可结合4个RBD,降低了单个RBD位点突变导致中和抗体失效的可能性。
比较双特异性抗体与单抗和抗体鸡尾酒策略在抗病毒活性和抑制逃逸突变能力方面的评价是本文的亮点之一:
病毒中和实验和小鼠感染模型的预防和治疗实验表明:bsAb15相对于抗体鸡尾酒策略具有更显著的中和病毒的活性。推测其原因包括:首先,bsAb15能够靶向RBD蛋白的不同表位,能够实现对RBD分子更多的受体结合位点的空间占位。其次,bsAb15双抗分子上有4个抗原结合位点,在体内实际发挥作用过程中,双抗可以结合在不同的S蛋白,甚至是不同病毒的S蛋白上,可能导致病毒交联聚集效应,进而可产生更强的中和活性。
活病毒传代培养实验表明:bsAb15能够更显著抑制逃逸突变的出现(至少在三代之后)。病毒的逃逸突变是病毒在环境压力下的一种概率性群体事件,与病毒复制纠错能力、病毒载量等自身因素以及宿主免疫选择压力等因素相关,其潜在机制有待于进一步研究。
此外,研究团队还针对bsAb15在体内对SARS-CoV-2感染的预防性和保护性进行了动物实验,发现它相比于亲本单抗和抗体鸡尾酒,更有效地降低了受感染的腺病毒载体制备的ACE2人源化小鼠的病毒滴度,且不同剂量的bsAb15在非人灵长类动物感染模型中均能够显著降低动物病毒载量。
进一步研究展望:
仍有突变会导致对bsAb15的抗性
双特异性抗体比普通单抗更能应对毒株变异的基本原理是:S蛋白中的一个突变不太可能同时导致两种抗体的无效。然而,同时出现在两个表位内的突变就可能会影响双特异性抗体的中和能力。
在本研究中,团队发现K417N和E484是两个重要的突变位点,它们分别可导致B38和H4结合的丧失,对迄今开发的大多数中和抗体的疗效构成了威胁,例如此次开发的bsAb15就会因此对Beta毒株失去中和效力。
对此,研究者提出:确定广泛的中和亲本单抗对于有效发展双特异性抗体是至关重要的。此外,谭曙光副研究员和吴燕教授也告诉果壳:“多特异性抗体同样是一个可行的思路,但需要兼顾后期生产的可行性。”
总之,目前相对于单一单抗、抗体鸡尾酒等其他策略,双特异性抗体确实是颇具优势的一类新冠抗体。它的优势在于:
集合了两个单克隆抗体的不同结合表位,能够耐受更多的病毒抗原位点突变,并能够降低治疗过程中病毒逃逸突变出现的概率;
单分子四价抗原结合能力,提高了病毒中和活性,特别是集成了具有协同效应的两株非竞争性中和抗体,其中和活性具有“1+1>2”的协同效应;
“鸡尾酒”混合疗法需要单独生产两种抗体,而双特异性抗体只需要生产一种,更加经济便利。
研究成果证明,bsAb15对早期毒株和近期流行的Delta毒株都具有显著的防治效果。可见,无论是在抗病毒活性、抑制逃逸突变的能力以及规避抗体依赖性增强效应等方面,还是在实际的临床应用和药物生产的成本效益方面,团队此次研发的bsAb15都是治疗和预防重症新冠肺炎的一种颇具前景的可行策略。
最后,研究团队还向果壳介绍:目前该双特异性抗体与山西亚宝药业合作,已经完成了临床前研究,正在进行临床试验的申报。
我们可以期待,科研团队的更多研究成果以及新抗体的早日投入使用,将帮助我们离战胜新冠疫情再进一步。
致谢
感谢中国科学院微生物研究所高福实验室谭曙光副研究员和首都医科大学基础医学院病原生物学系吴燕教授对本文的审阅及建议。
参考文献
[1] Li, Z., Li, S., Zhang, G. et al. An engineered bispecific human monoclonal antibody against SARS-CoV-2. Nat Immunol (2022). https://doi.org/10.1038/s41590-022-01138-w
[2] Wu, Y. et al. A noncompeting pair of human neutralizing antibodies block COVID-19 virus binding to its receptor ACE2. Science 368, 1274–1278 (2020).
[3] Zost, S. J. et al. Potently neutralizing and protective human antibodies against SARS-CoV-2. Nature 584, 443–449 (2020).
[4] Kemp, S. A. et al. SARS-CoV-2 evolution during treatment of chronic infection. Nature 592, 277–282 (2021).
[5] Lan, J., Ge, J., Yu, J. et al. Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor. Nature 581, 215–220 (2020).
[6] Edara, V. V. et al. Infection and vaccine-induced neutralizing antibody responses to the SARS-CoV-2 B.1.617.1 variant. Preprint at bioRxiv
[7] Wu, Y. et al. A noncompeting pair of human neutralizing antibodies block COVID-19 virus binding to its receptor ACE2. Science 368, 1274–1278 (2020).
作者:竹子
编辑:酥鱼
排版:尹宁流
研究团队
通讯作者 谭曙光:中国科学院微生物研究所高福实验室副研究员

通讯作者 高福:中国疾控中心主任,中国科学院院士

通讯作者 高峰:中国科学院天津工业生物技术研究所副研究员
通讯作者 吴燕:首都医科大学基础医学院病原生物学系教授

论文信息
发布期刊 《自然·免疫学》 Nature Immunology
发布时间 2022年2月28日
论文标题 An engineered bispecific human monoclonal antibody against SARS-CoV-2
(DOI:https://doi.org/10.1038/s41590-022-01138-w)
原标题:《高福/吴燕团队新成果:应对新冠病毒变异,开发双特异性抗体,对Delta防治效果显著》
