David E. Bec 著
林国乐 译
傅传刚 审
摘要:本章将讨论结直肠和肛门疾病诊断中的重要因素,包括患者病史、家族史、症状、体格检查、影像学检查和粪便检查等。
关键词:诊断,结直肠疾病,肛门疾病,家族史,体格检查,影像学检查,大便检查,潜血检查。
01
放射学检查
一
腹部X线片
怀疑急腹症时需行腹部放射学检查。尽管腹部 X 线片通常是非特异性的,但往往能提供潜在的问题线索,并能引导进一步、更具体的检查。因为腹腔内器官随体位变化,所以对异常发现的解释须与所用体位相关联。标准检查是仰卧位和直立位 X 线片,有时还应包括侧卧位 X 线片。腹部 X 线片可提供有关肠道内气体分布的有用信息;肿块和液体也有可能被看到。
正常情况下,大肠中的气体含量是可变的,而小肠中的气体含量很少。机械性肠梗阻时腹部 X 线片是通过异常形态或气体量来判断。气体移位是病变的标志,在不应该有气体的器官中存在气体,表明有肠瘘,例如胆总管十二指肠瘘的胆管中的气体或细菌产生的脓肿腔中的气体。患者直立时,腹腔内的游离气体最为明显。通常,直立胸部 X 线片能提供更好的图像。Chew 等 [22] 发现,严重溃疡性结肠炎患者如果在腹部X 线片上发现有 3 个或 3 个以上的小肠环充气,提示对药物治疗反应很差。
腹腔积液通常聚集在骨盆,所以是最需要关注的区域。当横膈有负压时,液体可能沿着结肠旁沟上升到膈下区域 [23]。腹腔积液的早期X 线征象是看液体密度,大量液体时可能会流到右、左结肠内侧或散在的小肠间隙。肾周和肾旁间隙的腹膜外液也可以用同样的方法检测到。
器官的增大(特别是肾脏、脾脏和肝脏)可以通过腹部 X 线片很容易地检测出来。囊肿或实体瘤的密度可以根据结构气体含量的改变(如胃、小肠和大肠)来描述或检测出。腹部 X 线片可显示各种结石、阑尾钙化,以及腹部动脉瘤钙化的粥样斑块。
二
计算机断层扫描(CT)
计算机断层扫描(CT)是一种利用计算机从射线衰减数据中构造图像的技术,然后将这些数据转换成数字打印输出所研究解剖部分的横截面图像,根据衰减或吸收值,产生的图像在密度上有所不同(图 3-12)。CT 可以观察到超过 2000 个密度差异,而不是常规 X 线检查所见的 4 个密度差异(空气、骨骼、脂肪和软组织),这就解释了 CT 的精细密度分辨能力,这是其检测小病灶能力的基础。CT 扫描使用 X 线,但对患者的辐射照射很小,相当于 1min 的透视或1/3~1/5 的标准放射检查的辐射照射,如钡灌肠造影或排泄性尿路造影 [24]。钡剂造影会造成此检查出现伪影和图像失真。腹腔内大量的金属夹会导致严重的条纹,并经常导致无法诊断。因为腹部脂肪为低计算机断层数字信号,从而有助于显出器官。使用稀释后的口服造影剂,如 2% 泛影葡胺(胃造影)有助于充分提高管腔内的密度, 特别是在较瘦的患者,这样可以区分肠管和腹部的实体结构。
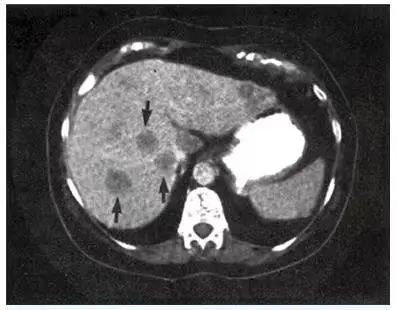
▲ 图 3-12
肝脏 CT,显示转移瘤的多发充盈缺损(箭)
CT 扫描常用于憩室炎、克罗恩病、小肠和大肠梗阻的诊断 [25]。对早期发现小肠梗阻坏疽也起到重要作用 [26]。CT 扫描还可以帮助诊断腹腔脓肿和评估结肠癌和肛门直肠癌。许多腹腔脓肿可以 CT 为引导经皮引流 [27]。对于大肠癌,虽然可通过钡灌肠或结肠镜检查,但 CT 扫描也非常有价值的,可以直接显示肠壁,肠系膜,并可看到恶性肿瘤是否浸润到周围器官。许多情况下,CT 扫描可直接用于疾病分期而无须剖腹探查 [28]。
原发性结肠癌最常见的 CT 表现是结肠壁局灶性增厚,还可以看到腹膜后转移,肝转移,直接侵犯骨盆肌肉、前列腺、子宫、膀胱、输尿管和脊柱,CT 对大肠癌分期的准确率在77%~100% 之间,可以带来高准确率的结果 [29]。新的CT 动脉门静脉造影技术对肝转移有 96% 的阳性预测率 [30]。CT 在直肠癌复发诊断中具有相当的潜在价值。理想情况下,应在术后 6~9 周进行 CT 扫描做为基准,然后每隔 6~12 个月进行一次,持续 2~3 年。CT 扫描可发现肝转移灶, 因为其衰减值低于正常肝实质。然而,在大多数情况下,CT 扫描不能提示组织学诊断,例如, 原发性肝癌不能与孤立转移区分开来 [31]。与囊肿相比,转移性病灶的边界不太清楚,密度也不均匀。Smith 等 [32] 的前瞻性研究表明,在检测肝脏转移性病变的任何成像方式中,其灵敏度或总体准确性均无统计学差异。肝脏闪烁扫描是最敏感的检查(79%),超声检查有最大的特异性(94%),CT 是总体最准确的(84%)。值得注意的是,所有 3 种检查方法都可能漏掉了直径 2cm 或更小的大多数病灶,所有直径 4cm 或更大的病灶都能被检测到。尽管CT 扫描技术有了进步, 但目前还没有一种影像学检查能够准确地分辨直径小于 2cm 的转移性病灶。
计算机断层扫描血管造影
计算机断层扫描血管造 影(computed tomography angiography,CTA)通过静脉造影剂、薄层多排 CT 及多种后期处理技术来输出高质量的图像。影响 CT 图像上活动性出血的可视化因素有很多,包括出血灶的性质(出血速度,时间间隔)、患者因素(血液动力学状态,体重指数)、放射技术(碘造影剂浓度和注射速度、时相、扫描仪类型、后期处理)以及放射科医生的经验 [33]。通过在 CTA 中增加额外的时相或可提供更多信息,但也会增加总辐射剂量。最新的研究表明,检测肠道出血时双相摄片方案(动脉和门静脉期)的灵敏度最高 [34]。双相摄片方案不但可以改善动脉期造影剂外渗的图像质量,而且可以提示出血原因 [35]。初期平扫可最大限度地减少将高密度物质(憩室中造影剂残留、药物、肠壁缝合材料、止血夹或钙化等)误判为造影剂外渗的发生及此可能导致假阳性结果 [36]。
将 CTA 纳入急性低位肠道出血的诊断流程有助于识别活动性出血的患者并准确定位出血部位。该信息有助于指导治疗,选择最优的止血措施:内镜、介入或外科治疗。出血点精准的解剖定位可以减少血管造影次数,从而节省时间、减少放射剂量并减少造影剂的负荷,实现靶向血管内栓塞 [37]。由于即便大范围的胃肠道出血也可以是间歇性地,所以发现活动性出血或潜在出血灶有助于指导介入科医师发现相关病灶并提高血管内治疗技术的成功率 [38, 39]。反之,完全阴性的 CT 结果会降低后续血管造影识别出血灶准确性,使医生治疗策略更为保守,仅采取“密切观察病情变化”的治疗策略,并为防止再出血反复CTA 检查 [40]。
发现和解剖定位可能导致出血的病灶并将其分类为血管源性、炎性、憩室或赘生性疾病(即使在没有活动出血的患者中)对于确定最后治疗方案也很重要 [41]。出血灶的检出准确率在80%~85% 之间 [41-43]。
荟萃分析证实常规血管造影和 CTA 在确定出血来源方面有良好的相关性 [33]。某些情况下,CTA 的敏感性甚至可能会超过常规血管造影 [42]。CTA 的局限性是必须应用可能会损害肾功能的静脉造影剂,这限制了其在肾功能不全患者中的使用。CTA 的便捷性及其定位出血灶的能力令许多中心将其作为严重消化道出血且肾功能正常的患者的初始检查 [44 , 45]。
三
计算机断层扫描结肠造影
计算机断层扫描结肠造影(computed tomography colonography,CTC)亦称虚拟结肠镜检查,是将螺旋 CT 扫描仪得到的高质量的轴向图像重新编排成二维(2D)(图 3-13A)和三维(3D)(图 3-13B)的结直肠的模拟图像。其肠道准备类似于行结肠镜检查。由于结肠平均长度为 1400mm,因此会产生约 560 张重排格式的图像(图 3-13)[46]。技术由 Vining 于 1994 年首次提出,并由 Hara 等于 1996 年成功应用于临床试验中 [46, 47]。
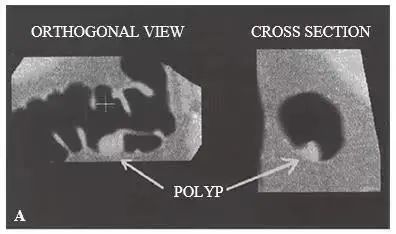
▲ 图 3-13
A. 二维 CT 结肠造影检出带蒂结肠息肉(由 C. Daniel Johnson, MD, Mayo Clinic,Rochester, MN 提供);
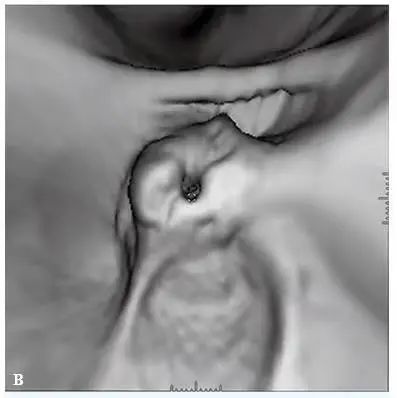
▲ 图 3-13
B. 三维 CT 结肠腔内造影检出巨大溃疡型盲肠癌(由 Robert L.MacCarty, MD, Mayo Clinic, Rochester, MN 提供)
CTC 作为结肠直肠癌筛查的潜在优势在于未来或可应用于未事先行肠道准备的患者,更高的患者可接受度(尚未证实)以及筛查重大肠外疾病的可能性 [48]。
由于研究方案不同,文献中CTC 的准确性差异很大。Pickhardt 等 [49] 报道了一项评价 CTC 筛查大肠癌的前瞻性研究,纳入1233 名同日接受 CTC 和结肠镜检查的无症状成人。超过 97% 的受试者处于罹患大肠癌的中危水平。放射科医生使用三维 CTC 显示腔内息肉, 他们发现 CTC 对大小 1cm、8mm 和 6mm 息肉的敏感性分别为 93.8%、93.9% 和 88.7%。结肠镜检查的敏感性分别为 87.5%、91.5% 和 92.3%。作者指出三维 CTC 是筛查成年人无症状中危大肠癌的准确手段,其与结肠镜检查相比具有优势。
Pineau 等 [50] 对 205 例患结直肠癌的中危受试者进行了类似口服造影剂的 CTC 相关前瞻性研究。他们指出 CTC 对 6mm 大小病变的敏感性为 84.4%,特异性为 83.1%,对 10mm 大小病变的敏感性、特异性分别为 90% 和 94.6%。值得注意的是,对于 6mm 大小病变的阴性预测率为 95%,对于 10mm 大小病变的阴性预测率为98.9%。
相反,Cotton 等发现 CTC 的敏感性低于结肠镜检查,而且各中心之间的准确率差异很大 [51]。在一项纳入在 9 家大型医院进行常规的临床结肠镜检查的 615 名 50 岁以上受试者的盲法评估的非随机、非劣效性研究中,研究者于多层扫描 CTC 后立即行结肠镜检。结果表明,CTC 检测≥ 6mm 病变的敏感性为 39%(95%CI, 29.6%~48.4%),检测≥ 10mm 病变的敏感性为 55%(95% CI,39.9%~70.0%)。这些结果明显低于常规结肠镜检查的敏感性 [ 分别为 99.0%(95% CI,97.1%~99.9%)和 100%]。Johnson 等前瞻性评估了 CTC 在大样本无症状低危人群中的表现 [52],同样地,被研究人群代表了接受CTC 筛查的患者样本,共有 703 名无症状者接受了 CTC,当天随即接受结肠镜检查。3 位经验丰富的放射科医生中的两名以盲评的方式对每位患者出具诊断性报告。以结肠镜检查为金标准,3 位放射科医师应用 CTC 独立识别 59 例大小为1cm 的息肉的准确率分别为 34%、32%、73%, 双人复审的准确率为 63%;识别 94 例大小为5~9mm 息肉的准确率分别为 35%、29%、57%, 双人复审的准确率为 54%。这项低患病率(5% 的患者患大小为 1cm 的息肉)研究的结果与其他医疗中心的报道(包括他们自己以前的报道)不同。技术和感知误差是造成 CTC 漏诊的原因,误差的原因是多方面的。技术误差被定义为两个观察员同时遗漏了息肉,该误差占直径 5~9mm 的息肉的 46% 和 1cm 的息肉的 37%。如果一个观察者识别出一个病变而另一个观察者错过了一个病变,则将其归类为感知误差,感知误差占 5~9mm 的息肉的 27% 和大于 1cm 的息肉的34%。息肉形态(如无蒂息肉)会影响检测率, 而非息肉位置。
判断 CTC 技术当前应用价值的局限性包括临床试验结果的巨大差异。目前尚无足够多常规临床实践方面,例如应用 CTC 筛查大肠癌的数据 [53]。
目前尽管双重对比钡灌肠也是一个不错的选择,而且成本较低,对于无法完成结肠镜检查或较不适合进行结肠镜检查的患者,CTC 似乎是可行的。此外在梗阻性结肠癌患者中进行 CTC(静脉内对比)也很有意义 [54]。
四
透视检查
1. 钡灌肠
回顾历史,硫酸钡灌肠很早就是检测大肠肿瘤的主要方法。如果正确操作,其准确性很高,并且大肠息肉检出率接近结肠镜检查的发现率 [55]。目前大多数放射科医生都认为气钡灌肠优于单纯灌肠 [56-58]。当肠道准备满意、操作得当时,放射科医师可以检测出大肠内的 4~5mm 的息肉。大多数遗漏的病变是由于肠道准备不充分、技术欠佳以及对细节的关注不足,而非病变过于隐蔽导致。高质量的气钡灌肠在诊断炎症性肠病方面也是准确和有用的。在不同解剖区域,以不同视角和角度以进行完整的结肠检查十分有必要 [59]。
钡灌肠通常是安全的,检查过程中约 40% 的人出现心律失常,可能与过于紧张有关 [31],但其少有损害。尽管这一事实的重要性尚不清楚,但对严重心肌缺血的患者应谨慎行钡灌肠。压力过高、灌肠器械尖端损伤引起的结肠和直肠穿孔,可以通过细致操作避免。肿瘤活检,不是钡灌肠的禁忌证。但是如果采用直肠乙状结肠镜或软镜直肠黏膜活检,应至少于 1 周后再行灌肠[60]。结肠镜或柔性乙状结肠镜活检标本取材很小且浅,因此只要确定不是非炎症性肠病,可以安全地立即进行钡灌肠检查 [61]。近期行息肉圈套电切或热活检后不可行本检查。结肠不全梗阻和急性憩室炎禁用硫酸钡灌肠剂。相反,可用水溶性灌肠剂。暴发性肠炎和中毒性巨结肠患者应用钡灌肠既不必要又不明智 [31]。儿童中,钡灌肠可用于肠套叠的复位。
2. 水溶性造影剂灌肠
许多急性或亚急性病症,如乙状结肠、盲肠扭转或结肠假性梗阻、结肠梗阻、吻合口漏,需要“是或非”的诊断,但不需要详细黏膜情况。这些疾病可能需要手术或结肠镜检查,最好避免钡灌肠。在这种情况下应使用水溶性造影剂,这类造影剂亦可安全地用于评估术后吻合口漏 [62]。
最常见的水溶性造影剂有泛影葡胺(Gastrografin)和泛影酸钠(Hypaque)等。与硫酸钡不同,如果发生穿孔这些水溶性试剂易从腹膜腔吸收,由于是透明液体,所以不会影响结肠镜检查的可视化,在肠切除时也不会充满肠腔 [63],它们还有助于清洁、清空结肠。使用水溶性造影剂的潜在危险在其高渗,可能导致已脱水患者更加严重的脱水。水性造影剂也对胃肠道黏膜有刺激作用,可能会导致严重的出血或炎症 [64, 65]。应谨慎使用水溶性造影剂,特别是在不全梗阻的情况下,可能会导致造影剂在肠腔内滞留。水溶性造影剂是术后小肠梗阻有用的诊断工具,并不会帮助缓解小肠梗阻 [66]。
多年来,结肠镜检查和钡灌肠之间的选择一直充满争议。由于影像和镜检在技术层面无法一概而论,因此比较两种检测结肠肿瘤的方法的前瞻性研究存在偏倚。在结肠肿瘤的诊断中,大多数研究报道钡灌肠的敏感性为 76%~98.5%,结肠镜检查的敏感性为 86%~95%[67-69]。大多数研究指出,如果操作得当,钡灌肠和全结肠镜检查对大肠肿瘤的检出均高度敏感。
结肠镜检查的优点是当看到息肉或癌时,可以进行活检或切除肿瘤。此外,术者有时可以冲洗或抽出粪便,以进行充分检查。缺点是成本高、费时,无法在任何情况下将肠镜进镜到盲肠以及并发症的风险。
钡灌肠的优点在于其成本较低、操作省时,更适合大规模筛查。缺点是难以区分粪便和赘生物,必须在绝对干净的肠道环境中进行检查,对盲肠和乙状结肠区域,由于无法很好的通过钡灌肠观察,需要乙状结肠镜或柔性乙状结肠镜检查。
Rex 等 [70] 的一项前瞻性研究对比观察了经验丰富的放射科医生与经验丰富的胃肠病医生后指出,在不告知放射科医生柔性乙状结肠镜的检查结果,且结肠镜检查人员对钡剂灌肠的结果不了解的情况下,放射科医生未额外发现在乙状结肠镜检查中的其他病变,但 114 例患者中有 9 例(8%)在结肠镜检查时发现了在乙状结肠镜检查和钡剂灌肠中均未发现的其他息肉。通过钡灌肠和柔性乙状结肠镜检查均发现远端结肠和直肠的所有 9 例癌灶。随着结肠镜检查的广泛应用,已成为结直肠疾病诊断性检查一线手段。当无法完成全肠道结肠镜检查或结肠镜资源受限时,可以采取钡灌肠检查。
3. 泌尿生殖系统检查
(1) 静脉尿路造影:虽然部分研究提出肠癌患者中有相当一部分存在泌尿系异常 [74],但其他研究指出这类异常的出现概率较低 [72]。在某些情况下,静脉输尿管造 影(intravenous urogram,IVU)很有价值,甚至必不可少。不主张常规进行 IVU 的一个原因是患者存在少量但确切的造影剂过敏反应风险,在既往有过敏反应史的患者这可能是致命的 [73]。
结直肠肿块较大时,如恶性肿瘤或憩室脓肿等,病变可能会粘连在输尿管上,或大肿瘤位于结肠右曲、结肠左曲,可能需要同时进行肾切除术的,强烈建议进行 IVU 检查。IVU 可显示输尿管有移位或梗阻,并可揭示放置输尿管导管必要性以提高手术的安全性。IVU 还为输尿管损伤时对侧肾脏功能的评价提供有用信息。在Cleveland Clinic 的大量研究中,克罗恩病患者的输尿管积水和肾积水的发生率为 5%。建议在此类患者行 IVU 检查 [74]。
(2) 膀胱造影:血尿和气尿需行膀胱镜检查, 必要时还需进行膀胱造影。对于发现的病变应行膀胱活检以揭示疾病的性质,尤其是排除恶性肿瘤。尽管一般而言钡灌肠在显示瘘管方面具有更高检出率,膀胱造影可以揭示瘘管之于膀胱的解剖特点。
(3) 瘘管造影:钡灌肠在提示结肠瘘方面非常有效 [75]。但对于结肠皮肤瘘,尽管钡灌肠可提示潜在引起瘘管的原发疾病,但最重要的信息是从瘘管造影中获得的,但要注意有关瘘管的精密设计检查方案,瘘口防漏密封。对于胃肠道瘘管,稀钡剂混合液优于水溶性造影剂。造影剂可经窦道引入的软橡胶导管或导尿导管注入,导尿管的气囊可在该窦道中膨胀以阻塞孔口。每个可被发现的瘘口都应插入导管,并在荧光镜下沿着双向录影检查造影剂的流动性。对于腹壁缺损较大且漏出物多的患者,不宜进行瘘管造影。常规造影剂通常可以更好地显示这种情况下的瘘管 [76]。
单纯性肛瘘管不需要瘘管造影。但高度复杂的肛门直肠瘘,瘘管造影可以显示出瘘管的深度和分支,对计划手术方法很有用。
五
超声检查
超声检查是一种应用高频声波的非侵入性成像技术。应用矿物油或水溶性凝胶作为表面耦合剂,将换能器直接应用于皮肤表面,换能器充当接收器以记录从人体反射的回声。使用超声成像的一个显著特征是它可以清楚地区分固体和液体结构(图 3-14)。超声检查的重要特征是它的安全性;没有辐射暴露的风险,非常适合儿童和孕妇。局限性是无法越过诸如肠气、骨骼、过多的脂肪沉积物和钡之类的声障。由于声波探头必须直接与皮肤接触,因此难以应用于有敷料、缝线、引流管、开放性伤口的术后患者。与 CT 和闪烁显像一样,超声检查肝转移癌的准确性很高,但比不上剖腹探查触诊 [77]。
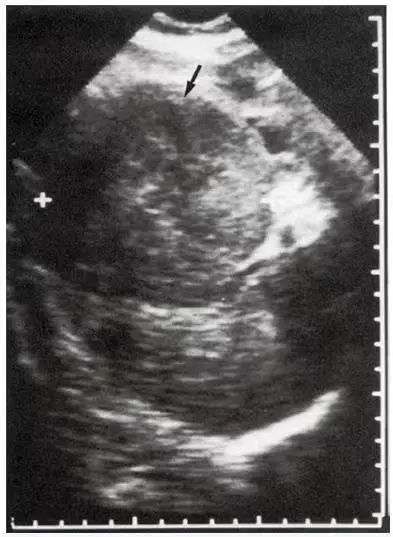
▲ 图 3-14 肝脏的超声图像
转移性巨大肿物(箭)
超声检查是检测腹盆腔积液极为灵敏的工具,但特异性不高,准确性不如 CT 扫描 [78]。由于肠道检查的敏感性有限,超声检查无法用于筛查肠道病变。肝脏超声检查可与 CT 扫描互补,以检测肝转移。
术中超声通过将超声探头直接放在肝脏表面检查,有助于发现无法通过肉眼和触诊发现的肝转移灶。多个研究者认为术中超声检查是肝外科手术检测术前影像学检查或手术时外科医生未发现的病变的首选方法。随着腹腔镜镜检和腹腔镜手术的广泛应用,目前已有腹腔镜超声探头用于肝胆胃肠道手术。腹腔镜超声检查作为一项更少侵入性的检查手段,提供结直肠癌分期与病理学诊断,未来可期 [79]。
直肠腔内超声:1956 年,Wild 和 Reid 在直肠腔中使用超声探头对直肠壁进行可视化检查[80]。因设备的局限性,直到 1983 年功能更强大的换能器问世,该方法才能实施 [81]。直肠腔内超声可以识别直肠壁不同层面,成为直肠癌术前分期的工具之一。在直肠癌的术前评估中,直肠腔内超声检查比 CT 扫描和磁共振成像(MRI)更为准确 [82]。但直肠内超声检查无法评估引起直肠狭窄或阻塞的病变。它判定恶性浸润深度的准确度为 85%~95%(图 3-15),在检测淋巴结转移方面的准确率为 60%~85%[83-85]。
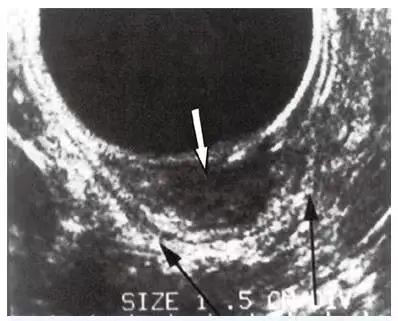
▲ 图 3-15
直肠腔内超声显示病变局限于直肠壁
(箭所示)。注意固有肌层是完整的
目前,直肠腔内超声是直肠癌术前分期的最佳工具。然而,由于术后瘢痕或放射反应的干扰,直肠腔内超声仅可发现 1/3 的被数字或内镜检查所遗漏的无症状局部复发灶 [86]。其检查肛管鳞状细胞癌放化疗后复发情况也很差 [87]。
近来,直肠腔内超声已被用于发掘肛门失禁患者的肛门括约肌缺陷和肛瘘评估 [88, 89]。
六
磁共振成像
磁共振成像(MRI)是利用体内原子的特殊性质和磁力来绘制体内器官图片的技术。因为没有电离辐射,MRI 比 X 线或注入放射性核素的检查更安全。但带有铁制品的患者无法行磁共振检查。
MRI 可像增强 CT 一样准确地检测出肝转移癌,但常规应用的价格昂贵。MRI 优于 CT 的唯一优势是它避免了辐射。MRI 在直肠癌分期中的准确性尚未达到临床有用水平 [90]。MRI 在发现复杂肛瘘方面是准确可行的 [91]。
经改良的直肠 MRI 分期可靠,正在迅速取代经直肠腔内超声 [92]。直肠 MRI 软组织对比显示效果卓越,从而可以测量肿瘤浸润深度(T 期),确定肿瘤浸润最深处与直肠系膜筋膜的关系,阐明肿瘤与括约肌群、腹膜反射和直肠周围静脉丛的关系。此外,MRI 能够评估直肠系膜筋膜以外的组织(包括骨盆侧壁)中的淋巴结和肿瘤情况,若以上组织得不到处理,将为肿瘤残留和(或)复发的埋下祸根。MRI 能够识别75%~90% 的位于腹膜反折前部的肿瘤 [93]。更多内容见直肠癌相关章节。
七
放射性核素扫描
早在 1954 年放射性核素就被应用于胃肠道出血的研究,但早期研究无法发现出血灶 [94]。随着放射性核素显像技术的进步,检测和定位胃肠道活动性出血灶已成为可能 [95-97]。 99mTc 硫胶体扫描已被废弃。取而代之的是带有红细胞标记的扫描。网状内皮细胞在肝脾中的摄取可能会掩盖结肠与肝、脾重叠部的出血。
1. 99mTc 标记的红细胞
循环中 99mTc 标记的红细胞在出血过程中渗出(图 3-16)。局灶放射性积累可提示出血位点。该技术的优点是红细胞可在循环停留更长的时间,因此可以在数小时后进行成像来检测间歇性出血。缺点是有外渗时不能精确成像定位,放射性试剂可随肠蠕动移动,导致出血部位的错误定位。对于活跃出血,尽管 99mTc 硫胶体扫描现已被核医学科医生广泛弃用,但其可以快速(5min 内)识别少量出血。缺点是诊断的时间窗很短(10~15min),因为药物会被肝脏迅速吸收。
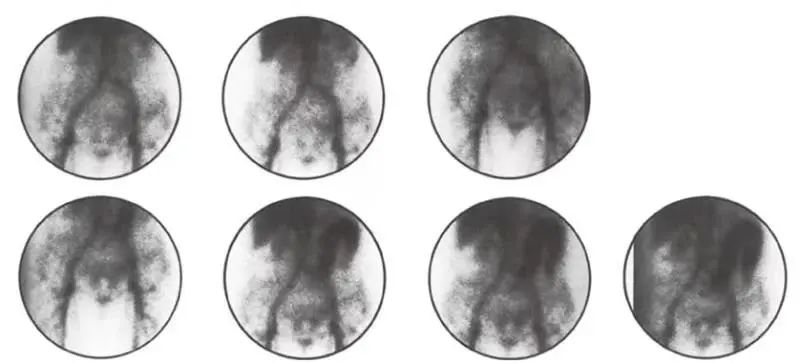
▲ 图 3-16 99mTc 标记的红细胞扫描提示
左半横结肠和降结肠的活动性渗血
由 Michael McKusick, MD, Rochester, MN 提供
放射性核素研究是非侵入性操作。一些学者将其用作动脉造影的后手,尤其是在大量下消化道出血的情况下 [35]。部分研究者将它们用作在轻度或间歇性胃肠道出血患者保守治疗过程中定位出血的初步诊断手段。当放射性核素检查未发现出血时,则无须即刻行进一步的诊断性检查,后续可选择性进一步治疗。若放射性核素检查提示有活动性出血,应立即进行动脉造影以确认出血部位 [48]。CTA(见前文)在许多机构中已经取代了红细胞扫描,因为 CTA 更易获得、速度更快,并且可以更好地定位于出血部位 [35, 45]。
除了 CT 和 MRI 之外,还有其他几种方法来检测腹腔内疾病。包括肝脏闪烁扫描显像、超声检查、直肠内超声检查、正电子发射断层显像(PET),以及放射性标记抗体成像。
2. 肝脏闪烁扫描成像
闪烁扫描成像术被广泛认为是有价值的检测肝脏转移的工具。静脉内注射 99mTc 硫胶体后,图像在核医学胶片上呈现后,即可获得肝脏闪烁成像。这种方法是利用病灶对 99mTc 硫胶体吸收不足这一特点来检测局限性肿块(图 3-17)。大多数研究显示其灵敏度为 80%~85%,但假阴性率和假阳性率也很高,为 15%~25%[98]。放射性核素扫描相对价格便宜且容易执行,但特异性较低。放射性核素闪烁成像术可以检测平均大小为2cm 或者更大的转移灶。但是,大多数检测到的病变是位于周围的,可能无法检测到位于中心的大病灶 [98]。Tempero 等的一项研究表明,肝脏未引起生化异常的转移性病灶可能太细微,内在肝脏扫描上无法产生局灶性改变 [99]。在实际操作中,肝脏闪烁扫描仅在肝功能检查异常时才使用 [99]。CT 很大程度上取代了肝脏闪烁扫描显像。
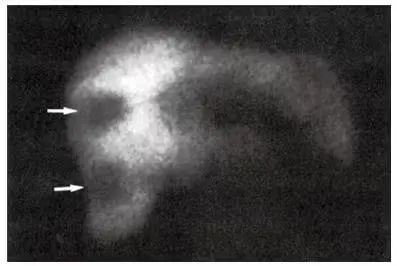
▲ 图 3-17
肝脏闪烁扫描成像上显示多个充盈缺损的转移灶(箭)
3. 正电子发射体层成像
PET 是一种新的成像方法,使用正电子发射的同位素标记的化合物。PET 利用恶性细胞中厌氧糖酵解增加这一特性,来获得结直肠肿瘤的功能图像。像葡萄糖一样,18F氟代脱氧葡萄糖(FDG)在细胞内被磷酸化。静脉注射时,由于所有细胞都需要使用该物质,因此会根据细胞的新陈代谢情况吸收不同的量。结直肠癌 FDG 的摄取增加(图 3-18)[79, 100]。PET 检查时,先向静脉内注射 FDG。1h 后,对腹部和骨盆进行放射成像。PET-FDG 图像可以分为矢状位、冠状位和横断位,并对每个视图的高代谢区域进行定性图像分析 [101]。PET 设备在美国多数大城市的重要诊疗中心中都有配备,尽管设备昂贵,但 PET 仍有望继续发展 [102]。Falket 等进行的一项试验性研究中,PET-FDG 成像在术前检测结直肠癌方面比 CT 更为灵敏和准确 [101]。PET-FDG 可以检测局部复发和远处转移性病灶,也能检测 CT 上未发现的其他转移性病灶 [103]。PET 对手术部位的复发病灶尤其有用,因为 CT 通常无法区分复发性病灶和病灶切除术改变 [104]。
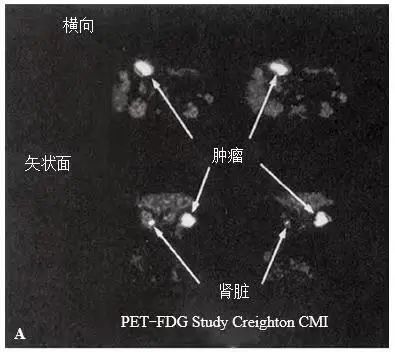
▲ 图 3-18A. PET
横断面和矢状面显示结肠右曲处有病变。
正常的肾脏摄取可见。
▲ 图 3-18B. 在 CT 中未发现 PET 上显示的病变。
CT. 计算机断层扫描;PET-FDG.
正电子发射断层显像 18 F脱氧葡萄糖 [101]
(引自©1994Wolters Kluwer)
一项对 11 项已发表研究的荟萃分析显示, PET-FDG 对复发性大肠癌的总体敏感性为 97%, 特异性为 76%,并且 PET-FDG 改变了 29% 的病例的临床治疗方案 [105]。然而 PET-FDG 成像对胃肠道黏液癌和神经内分泌肿瘤敏感性较低。可能与这些恶性肿瘤的代谢率较低有关。PET 的局限性在于其对小病变(< 1cm)的检测灵敏度低,并且无法区分彼此接近的病灶以及恶性坏死病灶。假阳性可由于炎性疾病引起,尤其是肉芽肿性病变。由于巨噬细胞活化,肉芽肿性病变可以摄取大量的 FDG[105]。
使用 PET-FDG 的重要指标之一是癌胚抗原(CEA)升高,但 CT 没有显示病灶。PET 检测出了 68% 的病例的复发 [106]。Flanagan 等 [107] 的研究显示 PET 的阳性预测价值为 85%,阴性预测价值为 100%。
PET 的另一个用处是在放化疗后跟踪随访患者。但放疗后约 6 个月内 FDG 摄取增高可能与炎症改变有关,不一定表明有残留癌变 [62]。
4. 放射免疫闪烁摄片
CT 和 MRI 在检测转移性疾病(尤其是肝外转移灶)的位置和范围方面的能力有限。它们无法检测到正常大小或< 2cm 的淋巴结中的转移灶。此外,无法区分瘢痕组织和术后改变,也无法区分癌症复发和术后放疗改变。
放射免疫闪烁摄片(RIS)使用标记有放射性核素(例如 111In 或 99MTc)以恶性细胞上的抗原位点为靶点的单克隆抗体(在这个例子中为CEA),这些抗体会产生伽马射线,被伽马相机检测到。肝转移灶可能表现为同位素活性或光感增强的区域。与之相比,CT 检测肝转移病灶更准确 [108]。
RIS 在转移性病灶检测中发挥着重要作用。大量研究报道了 RIS 在发现盆腔复发病灶中的作用 [109, 110]。RIS 和 PEI 均可用于检测隐匿性病灶和局部复发。它们是常规成像方法的重要辅助工具。
八
介入放射学
1. 动脉造影
自 1953 年 Seldinger 引入经皮导管造影术以来,这项技术在知识、技术和设备上都取得了巨大的进步 [111]。目前,很多医疗中心都可以使用动脉造影来诊断和治疗胃肠道出血。
结肠出血可以非常大并且威胁生命。目前,可以使用选择性大动脉造影术来诊断、治疗持续性大量出血。不仅在确定出血位置方面非常成功,而且可通过经导管栓塞或注射血管加压素控制出血 [112]。
2. 栓塞
难治性出血可能需要血管造影和经导管介入治疗 [113]。非侵入性成像(例如 CTA)可用于寻找出血点,并在血管造影之前确认活动性出血。如果血管造影确定了出血点,通常可以通过导管高选择性地进行栓塞有效控制出血,同时最大限度地减少并发症。栓塞剂的选择取决于血管解剖结构、血管造影结果、导管可达到的位置以及操作者的偏好。最常见的试剂是金属线圈、聚乙烯醇、吸收性明胶海绵和氰基丙烯酸正丁酯。栓塞可分为局部栓塞(高选择性栓塞止血)、近端栓 塞(栓塞上一级血管)和节段栓塞(栓塞相邻多个血管和分支)[114]。近端栓塞后若远端血管回流会导致出血点再通。如果节段栓塞过多,累及的肠道可能会发生缺血。
如果栓塞不成功,通过动脉造影导管选择性滴注血管加压素(垂体加压素)可以控制较低的胃肠道出血 [115]。这种方法是通过收缩肠系膜血管和肠壁平滑肌来起作用,减少血液流向出血部位,并诱导出血部位形成稳定的血凝块。因为血管加压素会引起冠状动脉血管收缩,患者要接受持续的心脏监测。以 0.1U/min 的速度开始输注血管加压素。20min 后再次进行血管造影,确认出血已停止且血管没有收缩过度。如果出血持续,血管加压素剂量应增加到 0.2U/min。如果出血仍不停止,输注速度将增至 0.4U/min。血管过度收缩会导致肠梗死。这种方法对于导管不可及的出血或弥漫性出血(例如出血性胃炎)有效。缺点是输液停止后再出血率较高、心血管并发症较多以及难以维持选择性导管的位置。在一项研究中,大量胃肠道出血时,血管加压素的成功率为 52%,低于栓塞 88% 的成功率 [116]。
急性致命性出血患者不应使用钡剂灌肠和结肠镜检查。钡剂可能会阻碍造影剂的外渗,动脉造影之前不得使用。但是,一旦出血减慢或停止,应通过结肠镜检查整个大肠。如果进行“结肠次全盲切术”,没有切除出血病灶,出血问题将无法解决 [117]。应积极寻找出血的确切解剖部位;一定不能忽视肛门直肠出血,需要通过直肠镜或肛门镜来进行检查排除。
为了确定出血部位,需要对正确的血管进行选择性动脉造影。肠系膜上动脉造影可以观察到小肠、升结肠和横结肠的出血。肠系膜下动脉造影可以观察到降结肠、乙状结肠和直肠的出血。胃肠道出血中,主动脉消化道瘘出血是唯一不能进行选择性动脉造影的,而是需要进行主动脉造影。选择性动脉造影仅适用于出血速率0.5ml/min 以上的持续出血,在临床上,如果为了维持患者血液动力学稳定, 需要每 8h 输血500m(l1ml/min),需要进行选择性动脉造影 [115]。
动脉造影是一种侵入性手术,但它的获益大于风险。在有经验医生的正确操作的情况下,动脉造影并发症的发生率很低。据报道,致命性并发症的发生率< 0.1%。较严重的并发症如血肿、感染、假性动脉瘤、动脉血栓发生概率是0.7%~1.7%,大部分情况下局限于动脉穿刺部位。约 5% 的病例发生轻微的并发症,大多数是穿刺部位血肿 [115]。
3. 经皮脓肿引流
经皮脓肿引流(PAD)基本上避免了手术探查引起的并发症和病死。图像引导的 PAD 中,CT 最合适 [118]。腹腔内脓肿 PAD 第一次的有效率可达 70%,第二次引流,有效率增加到82%[119]。一个包含 2311 例 PAD 病例的报道中成功率 80%~85%[120],并发症发生率为 0%~10%。PAD 可能会引起血管裂伤,但如果血管很小,出血通常会自发停止 [121]。也可能会因为针或导管在肠道中穿行导致肠穿孔,这样情况会很棘手。如果患者在肠导管穿刺后出现腹膜炎迹象, 可能需要进行手术干预。
4. 图像引导的经皮活检
大多数图像引导的活检可在门诊进行。所有的介入性手术都可能导致出血,但可以通过手术前纠正凝血系统疾病来减少这种并发症 [122]。超声检查有实时可视针头、成本低、便携、无电离辐射的优点。但因为在脂肪中很难观察到回声针,对肥胖病患者进行超声操作时会有困难。由于缺乏肉眼可见的病变,超声无法对位于骨或肠深处的病变进行活检。CT 几乎可以引导活检针到身体的任何区域,可以完美展现病变形态,并可以准确识别皮肤和病变之间的器官 [123]。缺点是成本较高、有电离辐射和手术时间较长。腹部、肝脏、肺部的活检可能出现出血、感染、气胸和咯血等并发症。术后出现气胸有时可能需要放置胸管并住院观察 [124, 125]。
5. 射频消融和化学栓塞肝转移病灶
利用射频消融(RFA)治疗肝转移病灶与图像引导的穿刺活检类似,只是用 RF 探针代替了穿刺针。射频探头置于在肝脏肿瘤中以高频率振动,将热量传导到病灶中并将其消融 [124]。研究表明,射频消融治疗结直肠癌肝转移的 5 年总体生存率与外科手术相近(25%~40%)[126]。射频消融没有绝对禁忌证,相对禁忌证包括血小板低和凝血系统疾病。对肝脏肿瘤进行 RFA 并发症发生率很低,通常低于 2%,主要有疼痛、胸腔积液、出血和脓肿 [124]。
经血管使用化疗药物治疗某些肿瘤(转移性肝癌),作为保守疗法,能够延长寿命,但并不能够治愈肿瘤 [126]。化疗方案有多种,化疗药物通常与栓塞剂混合,栓塞剂可以减慢血流速度,从而使药物保留在器官中。肝脏的转移性病灶也可以用负载钇的微球进行栓塞,微球可以发出 β 射线,仅有不到 1% 的患者会发生暴发性肝衰竭或肝脓肿,因化学栓塞引起的胆囊梗塞比较罕见 [126]。
参考文献
[22] Chew CN, Nolan DJ, Jewell DP. Small bowel gas in severe ulcerative coli tis .Gut. 1991; 32(12 ):1535-1537
[23] Hau T, Ahrenholz DH, Simmons RL. Secondary bacterial peritonitis: the b10- logic basis of treatment. Curr Probl Surg. 1979; 16(10 ):1-65
[24] lsikoff MB, Cuter M. Dagnostic imaging of the upper part of the abdomen.Surg Gynecol Obstet. 1979; 149(2):161- 167
[25] Taourel P. Pradel J, Fabre J-M, Cover S, Seneterre E, Bruel J-M. Role of CT in the acute nontraumatic abdomen. Semin Ultrasound CT MR. 1995; 16(2 ):151-164
[26] Ha HK. CT in the early detection of strangulat ion in intestinal obstruct io n.Semin Ultrasound CT MR. 1995; 16(2): 141- 150
[27] Bernini A, Spencer MP, Wong WD, Rothenberger DA, Madoff RD. Computed tomography-guided percutaneous abscess drainage in intestinal disease: factors associated with outcome. Dis Colon Rectum. 1997; 40(9):10 09-1013
[28] Gore RM, Moss AA, Margulis AR. The assessment of abdominal and pelvic neoplasia: the impact of CT. Curr Probl Surg. 1982 ; 19(9):493- 552
[29] Thoeni RF, Rogalla P. CT for the evaluation of carcinomas in the colon and rectum. Semin Ultrasound CT MR. 1995 ; 16 (2):112- 126
[30] Beasley HS. MR and CT imaging of intraabdominal spread of colorectal can cer. Semin Colon Rectal Surg. 2002; 13:105-118
[31] Amberg JR. Complications of colon radiography. Gastrointest En dosc. 1980; 26(2) Suppl:15S- I 7S
[32] Smith T 」 ,Ke meny MM, Sugarbaker PH, et al. A prospective study of hepatic imaging in the detection of metastatic disease. Ann Surg . 1982; 195 (4):486-491
[33] Wu LM, Xu JR, Yin Y, Qu XH. Usefulness of CT angiography in d1agnosmg acute gastrointestinal bleeding: a meta-analysis. World J Gastroenterol. 2010; 16(31):3957-3963
[34] Dobritz M, Engels HP, Schneider A, et al. Evaluation of dual-phase multi-de tector-row CT for detection of intestinal bleeding using an experimental bowel model. Eur Radiol. 2009; 19(4 ):875- 881
[35] Marti M, Artigas JM, Garzon G, Alvarez-Sala R, Soto JA. Acute lo wer intestinal blee ding: feasibility and diagnostic performance of er ang iography. Radiolo gy. 2012; 262(1):109- 116
[36] Jaeckle T, Stuber G, Hoffmann MH, Jeltsch M, Schmitz BL, Aschoff Aj. Detec tion and localization of acute upper and lower gastrointestinal (GI) bleeding with arterial phase multi-detector row helical CT. Eur Radiol. 2008; 18 (7) :1406- 1413
[37] Anthony S, Milburn S, Uberoi R. Multi-detector CT: review of its use in acute GI haemorrhage . Clin Radiol. 2007; 62(10):938-949
[38] Yoon W, Jeong YY, Shin SS, et al. Acute massive gastrointestinal bleeding: detection and localization with arterial phase multi-detector row helical CT Radiology. 2006; 239(1 ):160-167
[39] Kennedy DW, Laing CJ, Tseng LH, Rosenblum DI, Tamarkin SW. Detection of active gastrointestinal hemorrhage with CT angiography: a 4(1/2)-year ret rospective review. J Vasc lnterv Radiol. 2010; 21(6):848-855
[40] Jaeckle T, Stuber G, Hoffmann MH, Freund W, Schmitz BL, Aschoff AJ. Acute gastrointestinal bleeding: value of MDCT. Abdom Imaging. 2008; 33 (3):285-293
[41] Horton KM , Jeffrey RB, Jr, Federle MP, Fishman EK. Acute gastrointestinalblee ding: the potential role of 64 MDCT and 3D imaging in the diagnosis.Emerg Radio!. 2009; 16(5 ):349- 356
[42] Scheffel H, Pfammatter T, Wildi S, Bauerfeind P, Marincek B, Alkadhi H. Acute gastrointestinal bleeding: detection of source and etiology with multi-de tector-row CT. Eur Radio!. 2007; 17(6) :1555- 1565
[43] Ernst 0, Bulois P, Saint-Drenant S, Leroy C, Paris JC, Sergent G. Helic al CT m acute lower gastrointestinal bleeding. Eur Radio!. 2003 ; 13(1): 114-117
[44] nk SI, Ohki SK, Stein B, et al. Noninvasive evaluation of active lower gas trointestinal bleeding: comparison between contrast-enhanced MDCT and 99mTc-labeled RBC scintigraphy. AJR Am J Roentgenol. 2008; 191 (4):1107-1114
[45] Jacovides CL, Nadolski G, Allen SR, et al. Arteriography for lower gastrointes tinal hemor 「 hage: role of preceding abdominal computed tomographic an giogram in diagnosis and localization.JAMA Surg. 2015; 150(7):65 0- 656
[46] Hara AK, Johnson CD, Reed JE, et al. Detection of colorectal polyps by com puted tomographic colog raphy: feas lit y of a novel technique. Gastroenter ology. 1996; 110(1 ):284- 290
[47] Vining DJ. Virtual colonoscopy. Gastrointest Endosc Clin N Am. 1997; 7 (2):285-291
[48] Rex DK. Barium studies/virtual colonoscopy: the gastroenterologist's per spective. Gastrointest Endosc. 2002; 55(7) Supp l:S33- S36, discussion S36
[49] Pickhardt PJ, Choi JR, Hwang I, et al. Computed tomographic virtual colonoscopy to screen for colorectal neoplasia in asymptomatic adults. N En gl 」Med. 2003; 349(23):2191-2200
[50] Pineau BC, Paskett ED, Chen GJ, et al. Virtual colonoscopy using oral contrast compared with colonoscopy for the detection of patients with colorectal polyps. Gastroenterology. 2003; 125 (2):304- 310
[51] Cotton PB, Durkalski VL, Pineau BC, et al. Computed tomographic colonogra phy (virtual colonoscopy): a multicenter comparison with standard colono scopy for detection of colorectal neoplasia. JAMA. 2004; 291(14 ):1713- 1719
[52] Johnson CD, Harmsen WS, Wilson LA, et al. Prospective blinded evaluation of computed tomographic colonography for screen detection of colorectal polyps. Gast roenterology. 2003; 125(2 ):3 11- 319
[53] van Dam J, Cotton P, Johnson CD, et al. American Gastroenterological Assoc1一ation . AGA future trends report: CT colonography. Gastroentero log y. 2004; 127(3 ):970- 984
[54] Rex DK. Is virtual colonoscopy ready for widespread applicatio n? Gastroen tero log y. 2003; 125(2):608- 610
[55] Warden MJ, Petrelli NJ, Herrera L. Mittelman A. Endoscopy versus double contrast barium enema in the evaluation of patients with symptoms sugges tive ofcolorectal carcinoma. AmJ Surg. 1988 ; 155(2 ):224- 226
[56] Kelvin FM. Radiologic approach to the detection of colorectal neoplasia. RaClin North Am. 1982; 20(4) :743- 759
[ 57] de Roos A, He「 mans J, Shaw PC, Kroon H. Colon polyps and carcinomas: pro speclive comparison of the single- and double-contrast examination in the sa me patie nts . Radiology. 1985 ; 154 (1 ):11- 13
[58] Young j. The double contrast barium enema : why bother? South Med J.1982; 75(1):46- 55
[59] Miller RE. Detection of colon carcinoma and the barium enema.JAMA. 1974; 230(8 ):1195-1198
[60] Merrill CR, Steiner GM. Barium enema after biopsy: current practice and opinio n. Clin Radio!. 1986; 37(1):89-92
[61] Maglinte DD, Strong RC, Strate RW, et al. Barium enema after colorectal b1 一opsies: experimental data. AJR Am J Roentgenol. 1982; 139(4):693-697
[62] Sho 「 thouse AJ, Bartram CI. Eyers AA, Thomson JP. The water soluble contrast enema after rectal anastomosis. Br J Surg. 1982; 69(12 ):714- 717
[63] Ott DJ, Ge lfand DW. Gastrointestinal contrast agents. Indications, uses, and risks. JAMA. 1983; 249(17):2380- 2384
[64] Gallitano AL, Kondi ES, Ph 曲 ps E, Ferris E. Near-fatal hemorrhage followmg gast「ogra打n studies. Radiology. 1976; 118(1):35-36
[65] Lutzger LG, Factor SM. Effects of some water-solu ble contrast media on the colonic mucosa. Rad iology. 1976; 118(3): 545- 548
[66] Feigin E, Seror D, Szold A, et al. Water-soluble contrast material has no ther apeutic effect on postoperative small-b owel obstruction: results of a pro speclive, randomized clinical trial. Am J Surg. 1996; 171(2 ):227- 229
[67]Bolin S, Franzen L. Ni lsson E, Sjodahl R. Carcinoma of the colon and rectum. Tumors missed by radiologic examination in 61 pat ie nts . Cancer. 1988; 61 (10):1999 - 2008
[68] Reiertsen 0 , Bakka A, Trnnnes S, Gauperaa T. Routine double contrast ba rium enema and fiberoptic colonoscopy in the diagnosis of colorectal care 卜noma. Acta Chir Scand . 1988; 154(1):53- 55
[69] Irvine EJ, O'Connor J, Frost RA , et al. Prospective comparison of double con trast barium enema plus flexible sigmoidoscopy v colonoscopy in rectal bleeding: barium enema v colonoscopy in rectal bleeding. Gut. 1988; 29 (9):1188-1193
[70] Rex DK. Mark D, Clarke B, Lappas JC, Lehman GA. Flexible sigmoidoscopy plus air-contrast barium enema versus colonoscopy for evaluation of symp tomatic patients without evidence of bleeding. Gast 「 ointest Endosc. I 995 ; 42(2):132-138
[71] Peel AL, Benyon L, Grace RH. The value of routine preoperative urological as sessment in patients undergoing elective surgery for diverticular disease or carcinoma of the large bowel. Br J Surg. 1980; 67( I ):42- 45
[72] Phillips R, Hittinger R, Saunders V, Blesovsky L, Stewart-Brown S, Fielding P. Preoperative urography in large bowel cancer: a useless investigation? Br J Surg. 1983; 70(7 ):425- 427
[73] Madowitz 」S, Schweiger MJ. Severe anaphylactoid reaction to radiographic contrast med ia. Recurrences despites premedication with diphenhydramine and prednisone.JAMA.1979: 241(26):2813- 2815
[74] Siminov itc h 」M, Fazio VW. Ureteral obstruction secondary to Crohn's disease: a need for ureterolysis? AmJ Surg. 1980; 139(1):95-98
[75] Abcarian H, Udezue N. Coloenteric fistulas. Dis Colon Rectum. 1978; 21 (4):28I -286
[76] Alex ander-Willia ms J, Irving M. Intestinal Fistul as. Bristol : John Wright & Sons; 1982:60-61
[77] Grace RH, Hale M, Mackie G, Marks CG, Bloomberg TJ, Walker WJ. Role of ultrasound in the diagnosis of liver metastases before surgery for large bow el cancer. Br」Surg. 1987; 74(6) :480- 481
[78] Mueller PR, Simeone JF. lntra abdominal abscesses. Diagnosis by sonography
and computed tomography. Radiol Clin North Am. 1983; 21(3) :425- 443
[79] Tempero M, Brand R, Holdeman K, Matamoros A. New imaging techniques in colorectal cancer. Semin Oneal. 1995; 22(5) :448- 471
[80] Wild JJ, Reid JM. Diagnostic use of ult rasound. Br J Phys Med. 1956; 19 (11):248 - 257, passim
[81] Hildebrandt U, Feifel G, Schwarz HP, Scherr 0 . Endorectal ult rasound : instru mentation and clinical aspects. lnt j Colorectal Dis. 1986; 1(4) :203- 207
[82] Thaler W, Watzka S, Martin F, et al. Preoperative staging of rectal cancer by endoluminal ultrasound vs. magnetic resonance imaging. Preliminary re sults of a prospective, comparative study. Dis Colon Rectum. 1994; 37 (12): 1189- 1193
[83] Wong WD, Orrom WJ, Jensen LL. Preoperative staging of rectal cancer with endorecta l ultrasonography. Perspect Colon Rectal Surg. 1990 ; 3:315 - 334
[84] Harewood GC, Wiersema MJ, Nelson H, et al. A prospective, blinded assess ment of the impact of preoperative staging on the management of rectal cancer. Gastroenterology. 2002; 123(1 ):24- 32
[85] Yoshida M, Tsukamoto Y, Niwa Y, et al. Endoscopic assessment of invasion of colorectal tumors with a new high-frequency ultrasound probe. Gastrointest Endosc. 1995; 41(6):587- 592
[86] de Anda EH, Lee SH, Finne CO, Rothenberger DA, Madoff RD, Garcia-Aguilarj. Endorectal ultrasound in the follow-up of rectal cancer patients treated by local excision or radical surgery . Dis Colon Rectum. 2004; 47(6):8 18-824
[87] Lund JA, Sundstrom SH, Haaverstad R, Wibe A, Svinsaas M, Myrvold HE. En doanal ultrasound is of little value in follow-up of anal carcinomas. Dis Co lon Rectum. 2004; 47(6 ):839- 842
[88] Gold DM, Halligan S, Kmiot WA, Bartram Cl. lntraobserver and interobserver agreement in anal endosonography. Br」Surg. 1999; 86(3):371-375
[89] Cheong DMO, Nogueras Jj, Wexner SD, Jagelman DG. Anal endosonography for recurrent anal fistulas: image enhancement with hydrogen peroxide. Dis Colon Rectum. 1993; 36(12):1158- 1160
[90] Hadfield MB, Nicholson AA, MacDonald AW, et al. Preoperative staging of rectal carcinoma by magnetic resonance imaging with a pelvic phased-array coil. Br」Surg. 1997; 84(4):529-531
[91] Lunniss PJ, Barker PG, Sultan AH, et al. Magnetic resonance imaging of fistula-in-ano. Dis Colon Rect um. 1994 ; 37(7 ):708- 718
[92] dePrisco G. MRl local staging and restaging in rectal cancer. Clin Colon Rectal Surg. 2015; 28(3): 194- 200
[93] Gollub MJ, Maas M, Weiser M, et al. Recognition of the anterior peritoneal reflection at rectal MRI. AJR Amj Roentgenol. 2013; 200(1 ):97- 101
[94] Owen CA, Jr, Cooper M, Grindlay JH, Bollman JL. Quantitative measurement of bleeding from alimentary tract by use of radiochromium-labeled erythro cytes. Surg Forum. 1955; 5:663-667
[95] Alavi A. Detection of gastrointestinal bleeding wit h 99mTc-sulfur colloid.Semin Nucl Med. 1982; 12(2): 126- 138
[96] Markisz JA, Front D, Royal HD, Sacks B, Parker」A, I
[97] Winzelberg GG, McKusick KA , Froelich JW, Callahan RJ, Strauss HW. Detec tion of gastrointestinal bleeding with 99mTc-labeled red blood cells. Semin Nucl Med. 1982; 12(2):139-146
[98] Bernardino ME, Thomas JL, Barnes PA, Lewis E. Diagnostic approaches to hv er and spleen metastases. Radiol Clin No「th Am. 1982 ; 20(3 ):4 69- 485
[99] Tempera MA, Petersen RJ, letterman RK. Lemon HM, Gurney J. Detection of metastatic liver d is e ase. Use of liver sca ns and biochemical liver tests. JAMA. 1982; 248(11):1329- 1332
[100] Kim EE, Tilbury RS, Haynie TR, Podoloff DA, Lamki LM , Dodd GD. Positron emission tomography in clinical oncology. Cancer Bull. 1988; 40:158-164
[101] Falk PM, Gupta NC, Thorson AG, et al. Positron emission tomography for preoperative staging of colorectal carcinoma . Dis Colon Rectum. 1994; 37 (2):153-156
[102] Arulampalam THA, Costa DC, Loizidou M, Visvikis D, Ell PJ, Taylor I. Positron emission tomography and colorectal cancer. Review. Br J Surg. 2001; 88 (2):176-189
[103] Strasberg SM, Dehdashti F, Siegel BA, DrebinJA, Linehan D. Survival ofpa tie nt s evaluated by FOG-PET before hepatic resection for metastatic color ectal carcinoma: a prospective database study. Ann Surg. 2001; 233 (3):293-299
[104] Pham KH, Ramaswamy MR, Hawkins RA. Advances in posit ron emission tomography imaging for the GI tract. Gastrointest Endosc. 2002: 55(7) Suppl: S53-S63
[105] Huebner RH , Park KC, Shepherd JE, et al. A meta-analysis of the literature forwhole-body FOG PET detection of recurrent colorectal cancer. J Nucl Med. 2000; 41(7):1177-1189
[106] Valk PE, Abella-Columna E, Haseman MK, et al. Whole-body PET imaging with [1SF]fluorodeoxyglucose in management of recurrent colorectal can cer. Arch Surg. 1999; 134(5):503-511, discussion 511-513
[107] Flanagan FL, Dehdashti F, Ogunbiyi OA, I
[108] Saunders TH, Mendes Ribeiro HK, Gleeson FV. New techniques for imaging colorectal cancer: the use of MRI, PET and radioimmunoscintigraphy for pri mary staging and follow-up. Br Med Bull. 2002; 64:81-99
[109] Lunniss PJ, Skinner S, Britton KE, Granowska M, Morris G, Northover JMA. Effect of radioimmunoscintigraphy on the management of recurrent color ectal cancer. Br J Surg. 1999 ; 86(2):244-249
[110] Co 「 man ML, Galandiuk S, Block GE, et al. lmmunoscintigraphy with 111 In satumomab pendetide in patients with colorectal adenocarcinoma: per formance and impact on clinical management. Dis Colon Rectum. 1994; 37 (2):129-137
[111] Seldinger SI. Catheter replacement of the needle in percutaneous artenogra phy; a new technique. Acta Radiol. 1953; 39(5):368-376
[112] Athanasoulis CA. Angiography in the management of patients with gastrom testinal bleeding. In: Maclean LD, ed. Advances in Surgery. Chicago, lL: Year Book Medical Publishers ; 1983:1-20
[113] Zurkiya 0, Walker TG. Angiographic evaluation and management of nonvan ceal gastrointestinal hemorrhage. AJR Am J Roentgenol. 2015; 205(4):753- 763
[114] hin JH. Recent update of embolization of upper gastrointestinal tract bleed mg. Korean] Radiol. 2012; 13 Suppl 1:S31- S39
[115] Kadir S, Ernst CB. Current concepts in angiographic management of gastro intestina l blee ding. Curr Probl Surg. 1983 ; 20(5 ):281- 343
[116] Gomes AS, Lois JF, McCoy RD. Angiographic treatment of gastrointestinal hemorrhage: comparison of vasopressin infusion and embolizat ion. AJR Am J Roentgenol. 1986 ; 146 (5): 1031-1037
[117] Gianfrancisco JA, Abcarian H. Pitfalls in the treatment of massive lower gas trointestinal bleeding with "blind" subtotal colectomy. Dis Colon Rectum. 1982; 25(5 ):44 1- 445
[118] Lambiase RE. Percutaneous abscess and fluid drainage: a critical review. Car diovasc lntervent Radio!. 1991; 14(3): 143- 157
[119] Cinat ME, Wilson SE, Din AM. Determinants for successful percutaneous image-guided drainage of intra-abdominal abscess. Arch Surg. 2002; 137 (7):845-849
[120] Catalano OA, Hahn PF, Hooper DC, Mueller PR. Efficacy of percutaneous ab scess drainage in patients with vancomycin-resistant enterococci. AJR Am J Roentgenol. 2000; 175(2):533 - 536
[121] Boland GW, Lee MJ, Dawson SI, et al. Percutaneous abscess drainage compli cations. Semin lntervent Radiol. 1994; 11:267-275
[122] Bernardino ME. Percutaneous biopsy. A」 R Am 」 Roentgenol. 1984; 142 (1 ):41- 45
[123] Charboneau JW, Reading CC, Welch TJ. CT and sonographically guided nee die biopsy: current techniques and new innovations. AJR Am J Roentgenol. 1990; 154(1): 1- 10
[124] McGhanaJP, Dodd GD, Ill. Radiofrequency ablation of the liver: current sta tus. AJR Amj Roentgenol. 2001; 176(1):3-16
[125] Wood BJ, Ramkaransingh JR, Fojo T, Walther MM, Libutti SK. Percutaneous tumor ablation with radiofrequency. Cancer. 2002; 94(2):443-451
[126] Sullivan KL Hepatic artery chemoembolization. Semin Oneal. 2002; 29 (2):145- 151

本文摘自于傅传刚主译Gordon & Nivatvongs 结直肠肛门外科学:从理论到临床(原书第 4 版)
Gordon & Nivatvongs Principles and Practice of Surgery for the Colon, Rectum, and Anus
“肠”通无阻
END
“肠”久健康
同济大学附属东方医院
肛肠外科

同济大学附属东方医院肛肠外科是一个以结直肠肛门良恶性疾病治疗为特色,拥有南北两院三个病区,122张床位,8位国际著名结直肠外科专家客座教授,26位正式医生,其中正高6名,副高5名,博士生导师2名,硕士生导师4名,国家级学术专业委员会主任委员2名,副主任委员2名,集医教研于一体的专业化科室。在我国著名结直肠外科专家傅传刚教授带领下,近年来学科整体实力快速发展,在国际、国内的影响力和声誉度快速上升。学科拥有包括最新3D腹腔镜、各种手术能量平台、最新结直肠镜在内的各种先进诊疗设备;诊治内容涵盖结直肠肛门外科的所有疾病门类,包括结直肠息肉等的胃肠镜诊断和内镜下治疗;结直肠癌早期诊断和腹腔镜极致微创手术治疗;复发和局部晚期结直肠癌综合治疗和再次根治性手术治疗;慢性便秘、痔病、直肠海绵状血管瘤、家族性腺瘤性息肉病、巨结肠、溃疡性结肠炎、复杂性肛瘘、肛周脓肿、直肠脱垂、骶前肿瘤、复杂性直肠阴道(尿道)瘘等的手术治疗等。尤其“低位直肠癌保肛手术”、“3D腹腔镜极致微创无切口结直肠手术”、“局部晚期结直肠癌综合治疗基础上的联合脏器根治性切除”等,无论手术例数,还是长期和短期效果均国际、国内领先,具有广泛影响。学科连续举办10届大型国际学术会议《上海陆家嘴国际肛肠外科周》和《上海陆家嘴中日结直肠腹腔镜高峰论坛》,产生巨大国际、国内影响。

