以下文章来源于老顽童说 ,作者老顽童说
老顽童说.
公众号致力于传播衰老相关的前沿科研进展和趣味科普,帮助大家更深入地了解衰老背后的科学故事~

关注我们,获取更多相关资讯
翻译 by 李明恒 尹剑 燕浩腾 张亦欣
在当今信息化的时代背景下,“Ctrl + C” 和“Ctrl + V”已成为人们日常工作生活中的“神技”,但殊不知,在我们庞大的基因组中,存在一类被称为逆转录转座子的元件,同样具有这样的技能。它通过 “复制-粘贴”的方式不断增强它在我们基因组中的“存在感”,它不仅参与组成了我们的基因组,同时也发挥着重要的调控作用,与机体的多种生命活动息息相关。近些年,科学家们发现逆转录转座子也与衰老具有千丝万缕的关系。2021年8月4日,来自美国布朗大学的John M. Sedivy教授及其合作者在Nature上发表了题为 “The role of retrotransposable elements in ageing and age-associated diseases” 的综述文章,为我们梳理了逆转录转座子与衰老和老年疾病之间的联系。
John M. Sedivy 教授
(图源于网络)
摘 要
几乎所有生物体的基因组都包含逆转录转座子产生的重复序列。转座子是可移动的基因组元件,可以从基因组的一个位置移动到另一个位置,在这个过程中扩增并增加其“存在感”,有时会达到非常高的拷贝数。作者在本篇综述中讨论了一个新的观点:作为转座子的一个主要亚群,逆转录转座子的激活可以影响人类等复杂后生动物的衰老以及与年龄有关疾病的发生发展过程。自生命起源以来,逆转录转座子一直与宿主基因组共同进化,这种关系在很大程度上是竞争性的,因此转座子一直被冠以“垃圾DNA”或“分子寄生虫”的称号。我们对逆转录转座子进化的了解大多体现在它们在生殖系中的作用,从基因组序列数据中可以明显地看出这一点。最近的研究阐释了在个体生命周期中逆转录转座子的活性变化,以及逆转录转座子激活的分子机制,揭示了这些过程与个体的生理健康的相互关系。
正 文
转座子主要分为两类:一类是DNA转座子,通过“剪切-粘贴”机制借助DNA中间体移动;第二类是逆转录转座子,通过“复制-粘贴”机制移动,该机制涉及RNA中间体。35%的人类基因组包含逆转录转座子DNA序列。逆转录转座子可进一步分为长末端重复序列(LTR,long terminal repeat,源自于外源性逆转录病毒感染)元件和更原始的非长末端重复序列(Non-LTR,专职参与逆转录转座子生命周期)元件。Non-LTR逆转录转座子元件包括两个主要组成部分:长散在重复序列元件(LINEs,long interspersed nuclear elements,能够编码自身所需的蛋白质并进行逆转录转位)和短散在重复序列元件(SINEs,short interspersed nuclear elements,一种短链非编码RNA,能够“劫持”LINE编码的蛋白)。
逆转录转座子的攻击可能对机体具有重大危害,因此生命体有多重防御机制来应对这种潜在危害,然而逆转录转座子也会逐渐进化。在一个被称为“共选择、扩展适应或预适应”的过程中,随着进化时间的推移,宿主和逆转录转座子逐渐适应了彼此的存在。然而在宿主与逆转录转座子之间也存在一些有益的相互作用的例子,例如,着床前小鼠胚胎通过不同的LTR元件和LINE元件的转录激活而实现发育所必需的染色质状态的建立;果蝇的端粒通过特异性Non-LTR逆转录转座子来维持;LTR元件参与调节人类先天免疫途径的关键基因。这篇综述的重点是成体组织细胞中逆转录转座子的异常激活,特别是随着年龄增加而出现的逆转录转座子的异常激活,这种情况可能是对机体有害的。
宿主的防御机制是非常有效的,因此我们基因组中的大多数逆转录转座子都是在慢慢积累突变、缺失或重排。虽然在进化层面上一些较老的元件仍然可以通过顺式基因调控或重组机制影响宿主功能,但逆转录转座子的有害影响也越来越多地与衰老联系在一起。逆转录转座子对衰老的影响似乎在很大程度上取决于它们编码的蛋白质的活性,这种机制主要有三个类别:第一,与逆转录转座子相关的基因组和表观遗传效应;第二,与逆转录转座子相关的DNA损伤;第三,与逆转录转座子核酸相关的免疫途径的激活。最近,在与衰老相关的多种病理和疾病的状态或模型下,第三个机制类别(免疫途径的激活)受到了相当大的关注。
逆转录转座子的生命周期
不同的物种包含不同的逆转录转座子组合,它们的活性随着时间的推移而变化。果蝇和小鼠的基因组包含激活的LINE和LTR逆转录转座子,而人类基因组目前仅显示LINE-1(L1)和相关的SINE具有活性。L1占人类基因组的17%(约50万个拷贝)。然而,只有大约100-150个进化关系上最相近的元件拷贝是全长的,缺失或突变均可能影响其功能。
L1包含一个带有内部启动子的5’ UTR,两个开放阅读框(ORF1和ORF2)和一个带有聚腺苷酸信号的3’ UTR(见图1)。ORF1编码一个RNA伴侣,ORF2编码一个具有单链内切酶活性和逆转录酶活性的酶。最近在5’ UTR发现了一个功能未知的小ORF(ORF0)。L1的生命周期始于宿主RNA聚合酶II的转录。经加帽和聚腺苷化的L1的mRNA在细胞质中翻译后,两种编码蛋白与L1的mRNA发生顺式相互作用,形成核糖核蛋白体(RNP)。L1 RNP由许多包裹在mRNA上的ORF1三聚体组成,可能只有一两个ORF2分子与3’ UTR的富含A(腺嘌呤)的尾巴结合。
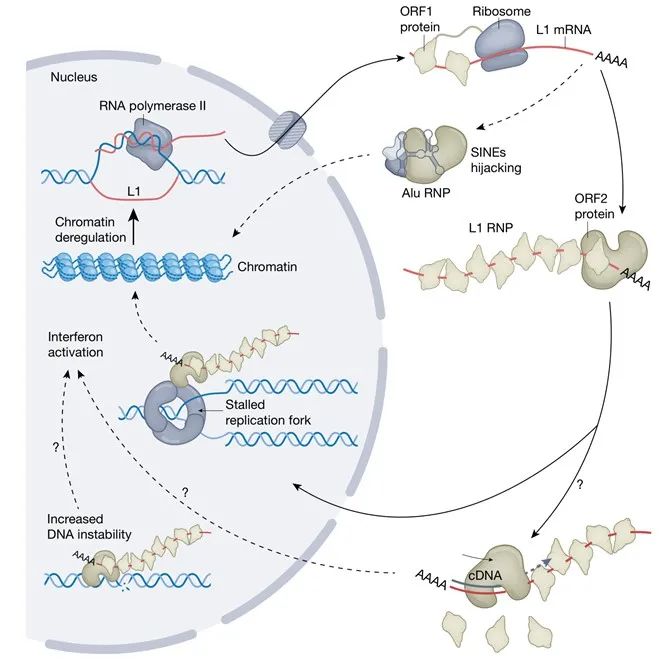
图1| L1生命周期。L1元件由宿主RNA聚合酶II转录。mRNA被(核糖体)翻译成ORF1和ORF2蛋白。多个ORF1三聚体和一个ORF2与mRNA顺式结合形成L1 RNP。SINEs反式“劫持”ORF2以形成自己的RNP。RNP在有丝分裂期间进入细胞核,并在S期与DNA复制机制相互作用以逆转录作用整合到基因组中。L1的cDNAs如何在非复制细胞中产生尚不清楚。
L1 RNP主要在有丝分裂期间进入细胞核。核酸内切酶在富含A和T(胸腺嘧啶)的位点切割基因组DNA链,以启动一个被称为靶序列引发逆转录(TPRT,target-primed reverse transcription)的过程(见图2)。然后,L1 mRNA的poly(A)尾与切割位点(位于DNA 3’端)附近的胸腺嘧啶核苷酸重组,从而能够通过逆转录作用将L1插入到DNA上。后续步骤目前研究尚不明确,但可能涉及宿主因素,以产生连接到宿主DNA的双链DNA(dsDNA)L1元件。这些发生在宿主DNA复制过程中的事件利用了与复制叉的相互作用。
LTR逆转录转座子的移动过程与逆转录病毒非常相似(见图2),它们编码的Gag样蛋白在细胞质中组装成衣壳样颗粒,逆转录则发生在这些结构内部,通常使用宿主tRNA作为引物产生cDNA,进入细胞核后通过整合酶插入基因组。尽管LTR逆转录转座子(包括内源性逆转录病毒)约占人类基因组的8%,但所有已知序列都发生了突变,而且似乎没有任何一个单独元件能够进行逆转录转座过程。人类内源性逆转录病毒K(HERV-K)在最近的进化中似乎已经“灭绝”,大猩猩基因组中仍然包含一些完整的插入片段。人类基因组中的几个其他HERV元件包含一些完整的ORF,特别是它们的包膜蛋白的表达被认为会导致肌萎缩侧索硬化和多发性硬化等神经系统疾病。
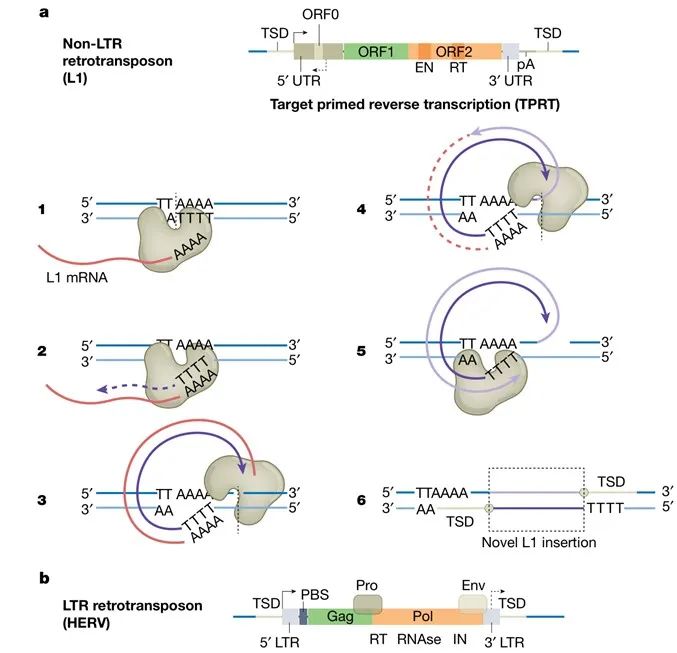
图2 | 逆转录转座机制。a,Non-LTR元件。L1结构:带有内部启动子的5’ UTR,米色;ORF0,浅米色;ORF1,绿色;ORF2,橙色;EN,ORF2的核酸内切酶结构域;RT,ORF2的逆转录酶域;带有聚腺苷酸化信号的3’ UTR,浅蓝色;TSD,靶位点重复序列。TPRT的步骤1–6。带箭头的深紫色(3,4,5)和浅紫色(4,5)线分别代表L1 cDNAs的第一条和第二条链。B,LTR元件。HERV结构:带有内部启动子的LTR(5’和3’),浅蓝色;PBS,tRNA引物结合位点;Gag(衣壳蛋白),绿色;Pro(蛋白酶),米色;Pol(聚合酶),橙色;Env(包膜蛋白),浅米色。许多HERV缺乏包膜蛋白。Pol具有逆转录酶、RNase H (RNase)和整合酶 (IN)活性的域。
逆转录转座子的沉默机制
宿主防御机制可以识别其基因组中的逆转录转座子DNA序列,并在发育早期在这些位置诱导异染色质化(见图3)。逆转录转座子的异染色质化需要募集染色质重塑酶和效应蛋白,包括SUV39H和SETDB1等组蛋白甲基转移酶、介导H3K27me3并维持染色质多梳结构的EZH2、以及HUSH复合体和RB1等其它因子。TRIM28(KAP1)通过招募SETDB1和HP1而成为几种靶向逆转录转座子的蛋白质的共阻遏物,如含有KRAB结构域的KZFP和SIRT6。这些因子的丢失减少了逆转录转座子上的异染色质,并减缓了对其的转录抑制。
DNA胞嘧啶甲基化是转录沉默的重要机制,与组蛋白修饰的机制密切相关。在哺乳动物中,逆转录转座子在成年体细胞的CpG位点被高度甲基化,在许多情况下低甲基化与它们的去抑制有关。DNA甲基转移酶(DNMT)的缺失或抑制导致L1元件的上调。相反,在小鼠中SINE不会因 Dnmt1 的缺失或用DNA去甲基化药物治疗而被解除抑制,而似乎主要受组蛋白甲基化的调节。值得注意的是,在果蝇中不存在胞嘧啶甲基化,尽管发现了 N6-腺嘌呤甲基化,但它似乎在逆转录转座子的沉默机制中没有起到重要作用。
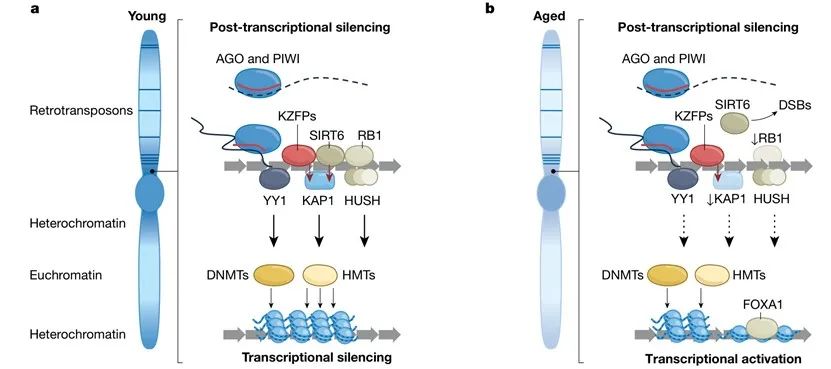
图3 | 逆转录转座子的“监管”。在每个面板左侧显示的染色体中,异染色质以深蓝色表示,常染色质以浅蓝色表示,逆转录转座子以水平深蓝色线表示。a,年轻状态。转录调节因子(KZFP、RB1、SIRT6、HUSH和YY1)靶向基因组中的逆转录转座子元件(粗水平箭头)。SIRT6和KZFP 都招募(红色箭头)共同抑制因子KAP1。AGO和PIWI通过siRNA或piRNA(红线)靶向新生的逆转录转座子转录本(虚线)。这些效应子共同募集(向下的黑色箭头)DNMT和抑制性组蛋白甲基转移酶(HMT)以促进异染色质的形成。逆转录转座子转录物也会被AGO复合物降解。b,年老状态。RB1和SIRT6等“监管机构”的效应减弱,导致KAP1募集减少、DNA甲基化减少以及逆转录转座子的异染色质修饰受到抑制,这允许转录激活因子(FOXA1)的结合。
组蛋白和DNA甲基转移酶通过多种途径和效应蛋白靶向逆转录转座子序列。人类基因组中有400多个KZFP与逆转录转座子共同进化,这就像是正在进行的“军备竞赛”的一部分。许多KZFP与基因组中的逆转录转座子元件结合,通过募集KAP1促进它们的异染色质化。逆转录转座子发生突变会避免这种“监管”,宿主生物体进化出变异的KZFP可以再次抑制新一代逆转录转座子。在小鼠胚胎干细胞中,一些LTR逆转录转座子被KAP1介导的SETDB1抑制,而不是被DNA甲基化抑制。人类胚胎干细胞中进化关系上年轻的L1元件在其5’ UTR的一个位点与转录因子YY1结合,神经元细胞中该位点的缺失与低甲基化和L1激活有关。进化关系上较老的L1家族受KAP1约束,DNMT的缺失会增加较年轻的L1元件的表达,但不会增加较老的L1元件的表达。因此,在许多情况下KAP1和DNMT依赖性通路具有单个逆转录转座子家族的互补作用。
短干扰RNA(siRNA)和PIWI相互作用RNA(piRNA)通过碱基配对机制将染色质抑制因子募集到逆转录转座子。siRNA来源于逆转录转座子序列产生的核双链RNA(dsRNA),由RNase-III-like Dicer酶加工处理。siRNA装载到Argonaute(AGO)效应蛋白上以形成沉默复合物,该复合物与新生的逆转录转座子转录本结合进而招募异染色质因子。在piRNA系统中,PIWI蛋白与piRNA结合,piRNA包含嵌入到逆转录转座子序列的非编码转录本。siRNA和piRNA也通过介导转录本降解来促进转录后沉默。
许多其他因素也在逆转录转座子“监管”中发挥作用:(1)RNA编辑酶,例如胞苷脱氨酶 APOBEC家族或ADAR;(2)RNA解旋酶—MOV10;(3)同源重组修复因子,如BRCA1;(4)三磷酸核苷酸水解酶—SAMHD1;(5)3’核酸外切酶1—TREX1。其中一些因素是针对外源病毒的防御,并通过多种机制发挥作用,例如通过编辑病毒或逆转录转座子的基因组,从而使其编码蛋白的序列发生错误;SAMHD1通过减少三磷酸核苷酸含量从而限制病毒或逆转录转座子cDNA合成;TEX1则可以直接通过降解病毒或逆转录转座子核酸的方式实现防御功能。
逆转录转座子在衰老过程中沉默下调
衰老与广泛的表观基因组重塑有关。这些改变是复杂的,一般是细胞类型特异的,但从酵母到人类等物种中均已观察到一个一致的现象,即衰老过程中存在异染色质的丧失和基因组位点相关的转录抑制。一些研究表明异染色质或异染色质生成因子的减少会加剧随着年龄的增加而增强的逆转录转座子活性。在果蝇中,H3K9me3和HP1在异染色质的近中心部位的修饰随增龄而下降。这些部位的逆转录转座子含量丰富,其与年龄相关的活化已通过若干研究得到证实。促进异染色质形成和/或逆转录转座子沉默的基因干预措施,会减弱与年龄相关的逆转录转座子活化,同时能够显著地延长寿命。
细胞衰老是一种不可逆转的增殖停滞,可以由各种应激(特别是DNA损伤)导致。虽然细胞衰老具有有益的功能(如肿瘤抑制),但衰老细胞会随着年龄的增加而在大多数组织中积累,它们是整个衰老进程的组成部分。而且由于具有强烈的促炎作用,衰老细胞已经与许多年龄相关的病理和疾病有因果关系。衰老伴随着染色质的复杂改变和重新排列。异染色质的相对减少已影响到逆转录转座子,并与它们的转录抑制相关。RB1的表达及其与L1元件的结合在衰老细胞中减少,这与L1位点的H3K9me3和H3K27me3的缺失有关。在衰老细胞中TREX1也被下调,转录因子FOXA1被上调,并结合到L1 5’ UTR。RB1和TREX1的敲低,以及FOXA1的过表达,可导致L1在人成纤维细胞中去抑制。
然而,衰老细胞只占老年组织中所含细胞的一小部分,不太可能引起目前已被观察到的所有逆转录转座子的激活。在多个物种中(包括线虫和果蝇)虽然发现了逆转录转座子活化,但这些物种似乎没有细胞衰老。在小鼠中,只有很少衰老细胞的组织(例如骨骼肌)存在随年龄增加的逆转录转座子的强烈激活。其中,一种可能的不依赖细胞衰老的机制与SIRT6有关,SIRT6通过与L1的5’ UTR和单ADP核糖基化的KAP1结合,然后招募异染色质因子HP1α和MeCP2,从而促进L1沉默。在老年小鼠的组织中,SIRT6 从L1元件中丢失,这可能与DNA 氧化损伤增加有关。在不同组织中,如果过表达SIRT6会抑制L1的年龄相关性表达增加。在小鼠中也描述了SIRT1的类似机制,而SIRT1同源物在果蝇中也涉及到对逆转录转座子的调节。值得注意的是,在复杂哺乳动物组织的处于不同衰老阶段的的衰老细胞类型中,逆转录转座子激活的程度尚不清楚。
基因组中富含异染色质和重复序列的基因缺乏区域,胞嘧啶甲基化往往随着衰老而缓慢下降,而基因相关CpG岛的甲基化增加或减少得更为显著,这具有明显的组织特异性效应。其中一些变化在同龄个体之间是保守的,甲基化位点的片段可用于设计与衰老高度相关的“甲基化时钟”。衰老细胞显示的变化总体上相似,虽然类似于癌细胞基因组中观察到的变化,但衰老细胞中更为明显。鉴于DNA甲基化、异染色质和逆转录转座子表达之间的联系,延缓衰老的干预措施也减慢了甲基化变化和逆转录转座子活化的进程,人们很容易推测这些事件之间是存在因果关系的。然而,DNA甲基化变化是衰老的早期事件,而逆转录转座子的激活发生的晚得多。在癌细胞中,逆转录转座子的激活在不同的癌症类型和不同的病例中是散在出现的。一个可能的解释是,衰老也会促使甲基化紊乱,这可能导致逆转录转座子的随机和渐进激活。
一些证据表明,小RNA通路会随年龄增加而发生一些改变,这些变化可能有助于增加逆转录转座子的水平。然而,除了染色质之外,大多数涉及逆转录转座子调节的系统在衰老的背景下还没有得到很好的研究,这为未来的探索提供了潜在的途径。
逆转录的结果
超过120个L1介导的转座子序列插入与人类遗传疾病有关。人类SINE Alu插入NF1基因与神经纤维瘤的发展有关。NF1基因似乎是Alu插入的热点,在18名神经纤维瘤患者中都已经发现了NF1的插入。然而,逆转录转座事件估计占所有NF1突变的0.4%左右,因此只是影响该基因的所有突变事件的一小部分。发育或成年期的逆转录转座将导致体细胞嵌合,通过定量PCR或单细胞基因组研究评估其在成人神经元中的发生频率,发现其发生频率不尽相同(但通常较低),有的研究显示小于0.04-0.6,有的研究证明大概在13.7、0.58-1、0.2或0.63-1.66。虽然没有详细研究其他组织中的逆转录转座的频率,但它们似乎要低得更多,因此成人脑可能是被特别允许的L1激活部位。
癌症的特点是基因组不稳定,这在许多情况下会增加L1元件的表达。一些工作确定了人类癌症的多个新生体细胞插入和相关的重新排列事件,在某些情况下,个体肿瘤的病例数可达数百例。在结肠癌的APC和子宫内膜癌的PTEN等肿瘤抑制基因中发现了一些插入,并与癌症的发展有关。然而,癌症中的大多数新插入都位于非编码序列中,并且不在肿瘤抑制因子或原癌基因附近。因此,目前几乎没有证据表明新的L1插入在肿瘤中起主要作用。
我们对基因间插入后果的了解仍然有限,例如,表观遗传效应(表观突变)对远端增强子、长链非编码RNA或染色质结构域的影响。这种插入可能会促进肿瘤的发展或机体对治疗耐受力的下降,因此,评估抑制逆转录转座过程是否会降低治疗后复发风险是很有趣的切入点。然而,在没有相反证据的情况下,我们可以初步得出结论,除某些神经退行性疾病外,L1或Alu插入引起的疾病负担可能很低。
激活先天免疫反应
细胞质中的DNA或dsRNA通常被视为入侵病原体。在脊椎动物中,它们的存在会触发干扰素系统,然后调控免疫反应。信号级联从各种传感器开始,如RIG-I和MDA5来检测细胞质dsRNA、环状GMP-AMP合成酶(cGAS)和AIM2来检测细胞质DNA,以及Toll样受体(TLRs)来检测内涵体腔中的各种核酸。这些信号被传播到细胞核,在那里它们启动I型干扰素(IFN-I)反应,其中涉及大量干扰病毒复制的因子的表达,如干扰素α和β表达来警示邻近细胞,调节各种细胞因子和趋化因子以及应答于免疫系统,并在某些情况下激活细胞死亡途径。
越来越多的证据表明,在某些条件下,逆转录转座子DNA序列在细胞质中积累。从Trex1突变小鼠的心脏细胞的胞质中发现了逆转录转座子DNA片段,测序显示相较于普通小鼠,L1、SINE和LTR逆转录转座子DNA显著富集。在TREX1缺乏的人类神经细胞中也发现了染色体外DNA,其中L1是主要来源。
最近,在与细胞衰老和个体衰老相关的正常细胞中发现了细胞质 L1 DNA。细胞质DNA也存在于Sirt6敲除小鼠的多个组织中,Sirt6敲除小鼠表现出早衰特征和L1元件的去抑制。值得注意的是,L1 DNA通过与DNA传感器cGAS关联而被鉴定。与DNA结合后,cGAS会催化GTP与ATP的反应,形成cGAMP(cyclic GMP–AMP)。cGAMP然后与干扰素基因(STING)结合,随后由激酶TBK1触发转录因子干扰素调节因子3(IRF3)的磷酸化。IRF3然后转移到核,在那里它激活IFN-I应答反应(Box 1)。
【Box1 细胞质"自我"DNA的不同来源】
cGAS-STING信号可以通过泄漏到细胞质中的各种DNA激活,如DNA损伤修复过程中产生的DNA片段、端粒DNA片段、微核破裂片段和由衰老细胞核自噬过程形成的细胞质染色质片段。细胞质DNA的另一个来源是线粒体受损,这会导致DNA从其中泄露并启动先天抗病毒反应。线粒体功能障碍已被证明是细胞衰老过程以及诱导衰老细胞促炎表型所必需的。另一研究发现,线粒体功能障碍是衰老细胞中细胞质染色质片段形成和炎症信号传导所必需的。这些不同的细胞质DNA在触发cGAS-STING信号时在功能上是如何相互关联的,在哪些细胞类型中和条件下形成的,目前尚不清楚。
在上述讨论的所有情况(TREX1或SIRT6缺乏、细胞衰老或机体自然衰老)中,细胞质L1 DNA均与IFN-I反应的激活相关。值得注意的是,使用抑制 L1 逆转录酶的核苷逆转录酶抑制剂(NRTI)药物治疗,或用针对活性L1家族的短发夹RNA(shRNA)抑制L1表达,可以减少细胞质L1 DNAs并改善cGAS和IFN-I的激活。这一发现表明,由逆转录酶活化产生的细胞质L1 cDNAs可以成为IFN-I反应的有效触发因素。
细胞质L1 cDNAs的产生机制尚不确定。在TPRT模型中,L1逆转录发生在细胞核中。一种可能性是细胞质L1 DNA是以某种方式从细胞核中输出的无效TPRT产物。然而,在有丝分裂后的衰老细胞中,人们猜测L1 RNP主要在细胞核之外。在非分裂细胞中,逆转录转座事件大大减少,尽管在衰老细胞或神经元中可以检测到低水平的逆转录事件。或者,逆转录可直接发生在细胞质中。如果提供引物,ORF2和L1 RNPs都可以在体外逆转录。在衰老细胞中,L1 RNPs可能积聚在细胞质中,因为它们无法进入细胞核。由于逆转录酶可以同时使用DNA和RNA引物和模板,所以细胞质RNPs可以使用尚未识别的引物生成cDNA。最近在与年龄相关的黄斑变性中报道了细胞质中的Alu在细胞质中自引发产生cDNA的现象。
也有研究表明,RNA传感器可以检测到逆转录转座子。逆转录转座子的dsRNA被加工成细胞核中的siRNA,通常在细胞质不能达到足够的数量以克服自体耐受。在某些情况下,例如使用脱甲基化剂治疗癌细胞,逆转录转座子上调由MDA5或TLR3传感器感知,从而触发IFN-I应答。dsRNA的主要来源是Alu反向重复序列,其通常由ADAR脱氨基以减少其双链特征,而MDA5可感知到加工减少,进而导致IFN-I激活。L1的过表达可以通过MDA5或RIG-I引起IFN-I响应,这可能是由L1 mRNA的某些二级结构介导的。
逆转录转座子的DNA和RNA传感对细胞衰老、个体衰老和衰老相关疾病的相对贡献仍有待彻底研究。迄今为止,许多工作都依赖于L1过表达、细胞系或限制逆转录转座子的机制受到损害的情况。值得注意的是,在一份报告中,在不表达cGAS-STING的细胞系中,NRTI治疗消除了L1介导的强烈的IFN-I应答。这可能是由于RNA-DNA杂交体激活了细胞质RNA传感器,或者L1 RNP被溶酶体进行了处理,在此过程中L1 cDNAs可以激活TLR9。另一种可能性是存在DNA和RNA传感器都参与的自体耐受的阈值,例如,IRF3上游的TBK1可以被cGASs-STING和RIG-I或MDA5激活。
促进DNA损伤
DNA损伤,特别是dsDNA断裂(DSB),可能作为与逆转录相关的“附带损伤”出现。在果蝇中,这可能是特别重要的,因为这个物种缺乏干扰素系统。相应的,它们存在基于Dicer-2和TLR介导的通过RNA传感的更原始机制,如激活抗菌肽产生的NF-κB途径;然而,DNA传感和cGAS-STING通路是不存在的。果蝇中的逆转录转座子激活与DNA损伤明显相关,通过促进异染色质化等干预措施可以减轻这种损伤。因此,由DNA损伤介导的细胞死亡可能是逆转录转座子对果蝇造成有害影响的主要原因。然而,这种生物体的先天免疫机制仍有待于在此背景下加以研究。
在哺乳动物中,逆转录转座子、DNA损伤、干扰素信号和炎症是错综复杂的交织在一起的。例如,逆转录转座子可以促进DNA损伤,但DNA损伤已被证明也会激活逆转录转座子表达。炎症可以通过不同的途径驱动DNA损伤,但DNA损伤也会引起炎症,就像细胞衰老一样。逆转录转座子触发先天免疫信号,但干扰素机制也可以调节逆转录转座子。在下面讨论的许多疾病示例中,炎症和DNA损伤并存,且二者的关系并没有得到仔细的拆解。鉴于目前缺乏定量数据,尤其是在自然衰老过程中,DNA损伤的频率是否可直接归因于逆转录转座子尚不确定。
衰老中的逆转录转座子
由于衰老会增加机体对各种疾病的易感性,人口老龄化已成为影响发达国家死亡率和发病率的主要原因。寄生虫感染显然对人体是有害的,如引起疟疾的线虫或疟原虫感染。逆转录转座子作为“基因组寄生虫”,是否可能促进衰老过程,是一个有趣的概念(图4a)。随着近期逆转录转座子的研究深入,人们意识到逆转录转座子活性可能会对单个个体的寿命产生影响。
在哺乳动物和果蝇中,逆转录转座子在细胞衰老和个体增龄过程中重新被激活。值得注意的是,沉默逆转录转座子的干预措施延长了果蝇的正常寿命,携带了去抑制逆转录转座子突变的果蝇会出现寿命缩短,而NRTIs治疗能够部分逆转这一现象。在小鼠中,NRTIs治疗使早衰型Sirt6缺陷小鼠的寿命延长了一倍,并改善了整体健康状况,包括骨密度、肌肉质量、肠道功能和运动能力。用NRTIs治疗中年野生型小鼠延缓了衰老生物标志物的生理变化,特别是DNA甲基化的水平和p16INK4A的表达。总而言之,这些研究表明逆转录转座子会促进衰老过程,而拮抗逆转录转座子活动的干预措施可能会延长健康寿命。
针对长寿动物的研究为探究衰老机制提供了有价值的见解。值得注意的是,寿命最长的啮齿类动物——裸鼹鼠的基因组中比其他啮齿类动物的基因组中含有更少的逆转录转座子,而长寿的蝙蝠的基因组中则充满了转座子。然而,蝙蝠已经进化出了对细胞质DNA的抑制反应。因此,寿命和转座子丰度之间可能没有直接相关性,但长寿物种可能会进化出更好的方式来应对逆转录转座子和相关炎症。
炎症已经成为影响多种老年疾病的一个因素,如癌症、心血管疾病和糖尿病,并且是许多神经退行性疾病的一个重要影响因素。免疫系统的慢性低水平激活现在被视为衰老的一个标志,通常被称为“无菌”炎症,因为它发生在没有明显病原体感染的情况下。引起无菌性炎症的原因可能有很多,但仍未被充分阐明。我们认为,将衰老过程中激活的逆转录转座子错误地识别为入侵病原体是无菌性炎症的关键驱动因素,进而导致许多与衰老相关的疾病。例如,流行病学证据表明,NRTIs可降低2型糖尿病的发病率。
逆转录转座子相关疾病
逆转录转座子在几种自身免疫性疾病中具有促炎作用(图4b)。在类风湿关节炎患者的滑膜液中发现L1转录因子水平升高。在也以诱导IFN-I为特征的系统性红斑狼疮(SLE)和干燥综合征患者中,L1元件呈低甲基化且转录本增加。已在SLE和家族性冻疮狼疮中发现了TREX1突变,表明TREX1可以作为对抗自身免疫性炎症的保护措施。SLE患者体内常检测到抗DNA的抗体,逆转录转座子cDNAs是否有助于产生这种抗体是一个有趣的思路。最近的一项研究在患有严重的SLE患者中发现了L1 ORF1蛋白抗体。L1 cDNAs是疾病的早期触发因素还是在其发病过程中较晚时期才出现的仍有待确定。因此,评估L1 cDNAs的抑制是否可以防止基因易感个体罹患自身免疫疾病,或减轻已确诊疾病的炎症反应,将是一项有趣的研究。
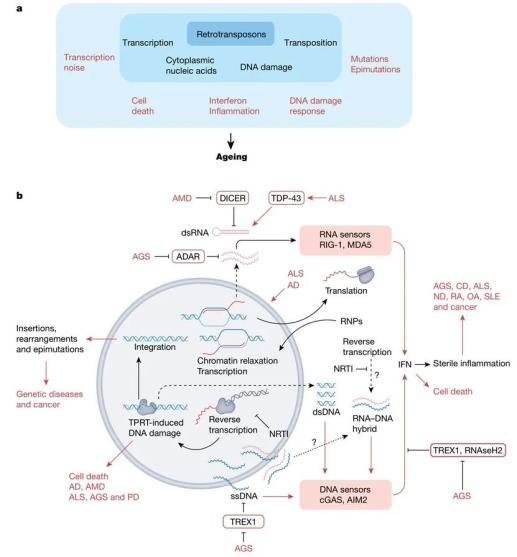
图4 |逆转录转座子是衰老和疾病的媒介。a,逆转录转座子-衰老相互作用概述。机体防御机制随着年龄的增加而减弱,这使得逆转录转座子(内层)被抑制。逆转录转座子活性(中间层)的直接分子结果驱动了几个细胞和组织水平的过程(外层),这些过程共同促进衰老。b,特异性逆转录转座子与疾病的相互作用。L1的转录和整合在细胞核内(双环),在细胞质中翻译和在两个室间的逆转录。DNA链用蓝色表示,RNA链用红色表示。ssDNA,单链DNA。疾病用大写的红色字母缩写(文本中没有定义的术语:AD,阿尔茨海默病;老年性黄斑变性(AMD);CD,心血管疾病;ND,神经退行性疾病;OA,骨关节炎;PD,帕金森病;RA,类风湿性关节炎)。箭头,激活效果;以条形结束的线,抑制相互作用;虚线箭头和问号,假设的或不确定的过程。
Aicardi-Goutières综合征(AGS)是一种与SLE相似且IFN-I诱导较强的儿童脑病。它是由TREX1、SAMHD1、ADAR和RNASEH2A的隐性突变或MDA5的显性突变(也称为IFIH1)引起的,这些突变都涉及到核酸加工或感知,尤其是逆转录转座子沉默机制。TREX1降解细胞质L1 DNA,其缺失引发cGAS-STING反应。用NRTIs鸡尾酒治疗Trex1缺陷小鼠,降低了它们的死亡率。SAMHD1与L1以多种方式相互作用,并可能将ORF1隔离成应激颗粒。RNaseH2消化RNA-DNA杂交的RNA链,并可能降低与干扰素感受器相互作用的L1核酸水平。ADAR编辑Alu RNA, MDA5的功能获得性突变表明在AGS的某些病例中涉及RNA感知机制。激活干扰素感受器的核酸在多大程度上来自慢性DNA损伤或逆转录转座子尚不清楚。然而,一项使用NRTIs的临床试验得到了积极的结果。
L1激活在癌症中的作用尚不清楚。炎症可能通过诱导细胞增殖而促进癌症的发生;另外,L1引发的干扰素反应或DNA损伤可能会促进细胞死亡。L1元件由于DNA甲基化的缺失而被激活,这在癌前增生过程中经常发生;由此产生的IFN-I反应可能会触发细胞死亡途径。IFN-I反应也可以使肿瘤细胞暴露于免疫系统的监视之下。因此,L1,或者更广泛地说,逆转录转座子,它们可能具有肿瘤抑制因子的作用。慢性干扰素信号也可以促进形成一种免疫抑制环境。
逆转录转座子也与一些年龄相关的神经退行性疾病有关。年龄相关性黄斑变性与DICER1的下调有关,随之Alu RNA水平的升高激活视网膜色素上皮细胞中NLRP3炎性小体,导致细胞毒性和变性。Alu RNA在细胞质中被逆转录,cDNA激活cGAS-STING信号通路,随后的IFN-I和炎症反应可被NRTIs治疗减轻。
肌萎缩侧索硬化症和额颞叶痴呆以TDP-43的胞浆聚集为特征。TDP-43通常定位于细胞核,尽管其功能尚不完全清楚,但其胞质聚集与疾病密切相关。在人死亡后的大脑中,核TDP-43的丢失与富含逆转录转座子染色质区域的开放有关。有人提出宽松的染色质环境有助于L1和HERV表达。在ALS患者和ALS132-134小鼠模型中发现了干扰素和炎症标志物水平的升高。人TDP-43在果蝇大脑中过表达可诱导逆转录转座子的去抑制,包括逆转录转座子LTR元件Gypsy。逆转录转座子似乎介导了随之而来的DNA损伤相关的细胞毒性,因为这些效应被NRTIs逆转了。
神经原纤维缠结是由微管相关蛋白tau (MAPT)的不溶性聚集物形成的,是阿尔茨海默病和其他tau蛋白病的标志。阿尔茨海默病患者的死后脑样本显示开放染色质标记物增加,逆转录转座子表达升高。一种与疾病相关的人类tau蛋白在果蝇神经元中的表达引发了H3K9me2的缺失、广泛的逆转录转座子激活、DNA损伤和神经元细胞死亡,NRTIs可以挽救这些细胞。在人类皮质样本中,逆转录转座子表达与结瘤负担呈正相关,同时HERV某些位点的开放染色质标记H3K9ac富集。散发性阿尔茨海默病与淀粉样前体蛋白(APP)的加工假基因插入有关,其中一些可能表达疾病相关的变异,并依赖逆转录酶活性插入成人神经元基因组。
在毛细血管扩张共济失调患者的脑组织中检测到细胞质逆转录转座子DNA,这是一种由ATM突变引起的神经退行性和癌症倾向综合征,ATM编码一种蛋白激酶,调节细胞周期检查点、DNA修复和凋亡,以应对DSBs。在果蝇胶质细胞中抑制ATM激酶可以激活先天免疫反应并引起神经退行性变。ATM的丢失与人类神经祖细胞中L1逆转录转座事件的增加有关,ATM在小鼠小胶质细胞中的丢失导致细胞质DNA的积累、cGAS-STING轴的激活和神经毒性细胞因子的产生。这些反应在多大程度上是由逆转录转座子或受损DNA修复产生的核DNA片段驱动的,目前仍有待确定。
治疗前景
探究逆转录转座子在衰老和老年疾病中的作用为开发新的衰老治疗方法提供了机会。自身免疫性疾病通常用抗炎药物治疗,如肿瘤坏死因子(TNF)拮抗剂,它针对的是反应的更远端方面。STING小分子抑制剂已经被鉴定出来了,并发现可以改善小鼠模型中STING介导的炎症环境,而cGAS抑制剂正在研制中。值得注意的是,一些较老的药物,如阿斯匹林和抗疟疾药物阿奎那平和氯喹抑制cGAS,进一步表明下调这一通路可能有益于健康。过度针对免疫机制的治疗的缺点是它们可能增加机体对感染的易感性。
在多种模型和情况中出现的一致特征是NRTIs可缓解逆转录转座子激活的效果。这一发现十分有趣,考虑到逆转录转座子生命周期的某些方面不应该直接受到NRTIs的影响,如元件的转录或RNA感受器的刺激。一种解释可能是RNA和DNA感知途径之间的下游交叉和整体自我耐受阈值的存在。另一种可能是由于NRTIs的抗炎特性,据报道在无逆转录酶参与的情况下,NRTIs可以缓解NLRP3炎症小体的激活。许多NRTI药物已被美国食品和药物管理局(FDA)批准用于治疗艾滋病毒感染,而且通常耐受性良好。然而,NRTIs并非没有副作用,因为它们可以被线粒体DNA聚合酶或端粒酶等细胞聚合酶识别。
最新的逆转录转座子的抑制方法是加强导致其沉默的表观遗传机制,特别是那些随着年龄的增加而受损的机制。SIRT6就是这种表观遗传调节剂之一。过表达Sirt6的雄性小鼠寿命会增加,这可能部分是由于其更有效地沉默了L1元件和减轻炎症。SIRT6参与多个过程,包括DNA修复、端粒维持和代谢。SIRT6的小分子激活剂正在开发中,可能会提供一系列的健康益处,包括促进逆转录转座子的沉默。
这些发现阐述了一个较为统一的观点,即随着年龄的增加,宿主控制逆转录转座子的能力下降,从而导致它们的去抑制并最终激活固有免疫途径、造成细胞毒性和功能退化。引发衰老的因素多种多样,包括遗传倾向、环境影响和自然衰老过程本身。最近研究发现干扰素通路的激活是逆转录转座子激活的主要下游机制,并为逆转录转座子与其宿主的关系提供了一个新的思路。逆转录转座子激活先天免疫信号会在所有体细胞中发生,包括有丝分裂后的细胞,而不需要实际的逆转录转座过程。炎症过程研究的逐步加深与我们对炎症在衰老和许多老年疾病中的核心作用的新认识产生了良好的共鸣。
展望
为了进一步了解在成体组织中逆转录转座子激活的机制和后果,基础生物学方面仍有许多工作要做。异染色质化是逆转录转座子抑制的重要机制,而在衰老过程中发生的异染色质丢失和重新分布的机制仍需要进一步对其研究。其他逆转录转座子抑制途径(如siRNAs和piRNAs)也需要更全面的研究,尤其是在哺乳动物中。启动监测系统的上游刺激开始进入研究者的视野(例如,SIRT6重新定位到DNA损伤位点 ,或由于TDP-43重新定位到细胞质中而导致 L1 染色质开放),但我们对这些机制的认识还很基础,需要更全面地了解衰老和疾病之间的关系。
逆转录转座子在衰老细胞中的激活已被证实,但其在有丝分裂后细胞(如神经元或肌细胞)中的激活程度和机制尚不清楚。L1在增殖细胞和衰老或有丝分裂后细胞中似乎有不同的生命周期,但后者完全不为人所知。一旦逆转录转座子被解除抑制,干扰素的激活是导致衰老和疾病的主要后果吗?DNA损伤、对它的反应和细胞死亡的相对作用是什么?对于促炎效应,DNA感知和RNA感知通路的相关作用是什么?L1已成为IFN-I激活的关键驱动因子,但刺激cGAS-STING信号的细胞质L1 cDNAs的起源尚不清楚。L1 元件和 HERV 对人类疾病的相对影响是什么?很显然,逆转录转座子在不同物种、细胞类型和疾病中存在异质性,而阐明哪些逆转录转座子被激活以及它们在不同情况下是如何被感知的,这将是一项重要工作。
首先,需要确定哪些患者是由逆转录转座子激活引发疾病的。为此,有必要开发能够可靠地检测逆转录转座子激活的生物标志物,用于患者检测。在潜在的治疗方面,NRTIs已经符合预期。鉴于近期NRTIs在治疗HIV中的良好安全记录,将这些药物用于各种适应症是可行的。对于年龄相关性疾病的长期治疗,特别是老年人群,耐受性更好的药物将是更好的选择。一种策略是开发新的、高效的、专门针对逆转录转座子逆转录酶的NRTIs。结合HIV逆转录酶上非催化位点的非NRTI抑制剂已经相当成功,同样的策略也可以应用于逆转录转座子。也可以考虑靶向其他功能的药物,如L1内切酶或破坏RNP复合物稳定性的药物。此外,包括针对逆转录转座子参与的多种途径(如DNA损伤)的药物的联合疗法也值得研究。

来源:老顽童说
原标题:《【重磅综述】逆转录转座子与衰老及老年疾病》
