细胞焦亡(pyroptosis)是一种高度炎性和裂解性的程序性细胞死亡。作为杀死被感染细胞、释放IL-1家族细胞因子的一种手段,细胞焦亡通路在信号异常时可能导致严重的免疫系统紊乱,包括痛风、败血症等;阿尔茨海默病、帕金森氏病等神经退行性疾病,也与细胞焦亡密切相关。因此,阐明细胞焦亡的调控机制,对于抵抗病毒、细菌等病原体感染,治疗自身免疫性疾病,减缓神经退行性疾病等具有重要意义。
病原体相关分子模式(PAMP)和机体自身衍生的损伤相关分子模式(DAMP)均可通过多种形式激活炎性半胱天冬酶Caspase家族,进而剪切下游蛋白GSDMD,促进其N端(GSDMD-N)高聚并在细胞膜上形成孔洞,诱导炎症因子及其他细胞内容物释放和细胞裂解性死亡,激发强烈的炎症反应。然而,焦亡关键蛋白GSDMD如何高聚,什么因子可以促使其高聚并引起细胞焦亡的动态调控机制并不清楚。
2021年9月11日,复旦大学生命科学学院李继喜、附属华山医院陈向军团队在Cell Death and Differentiation杂志上发表文章TRIM21 regulates pyroptotic cell death by promoting Gasdermin D oligomerization(TRIM21促进Gasdermin D高聚从而调控细胞焦亡),发现和鉴定到细胞焦亡的新型调控因子TRIM21。

李继喜课题组长期从事细胞死亡的结构基础与调控机制研究。在细胞焦亡领域,通过X-光晶体衍射方法解析了GSDMD-C的精细三维结构,阐明了GSDMD蛋白的自抑制机理(2017,Proc Natl Acad Sci USA);同时也解析了RIPK1/RIPK3坏死小体复合物的高分辨率三维结构(2018,Cell),并发现和鉴定了细胞坏死通路中降解RIPK3的负调控分子TRIM25(2021,Cell Death Differ)。
在本研究中,李继喜/陈向军团队通过高灵敏质谱分析,筛选并鉴定到GSDMD的结合蛋白TRIM21,并证明TRIM21与GSDMD在体内外均直接相互作用。TRIM21通过PRY-SPRY结构域结合GSDMD,维持GSDMD在静息细胞中的稳定表达,并在细胞焦亡过程中诱导GSDMD-N高聚。NLRP3或NLRC4炎性小体激活后,TRIM21缺陷型细胞死亡率显著降低;同时在沙门氏菌感染情况下,TRIM21敲除的BMDM细胞也显著提高了存活率。此外,TRIM21敲除小鼠在脂多糖(LPS)诱导的败血症和葡聚糖硫酸钠(DSS)诱导的结肠炎模型中,炎症反应明显减弱,存活率显著提高。这项研究揭示了TRIM21在GSDMD介导的焦亡中发挥重要作用,为控制和治疗炎症相关疾病提供了全新作用靶标。
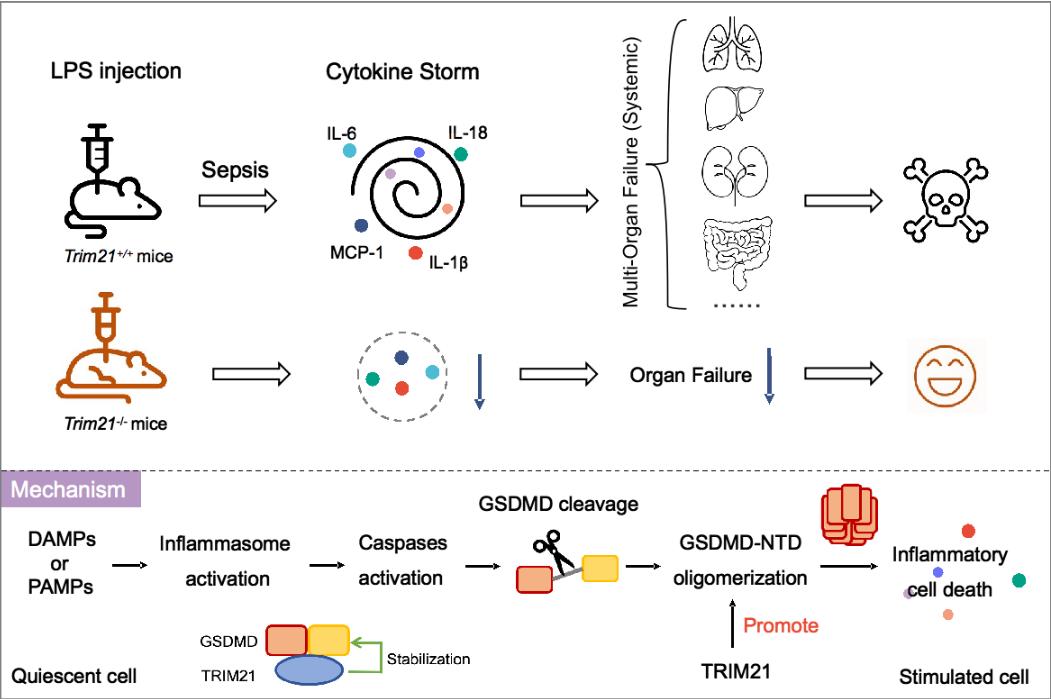
图示:TRIM21促进GSDMD高聚,从而正向调控细胞焦亡。
高文青博士和博士研究生李媛媛为论文共同第一作者,李继喜教授和陈向军教授为论文共同通讯作者。
原文链接:
https://www.nature.com/articles/s41418-021-00867-z
来源:BioArt
网站:www.cscb.org.cn
微信:CSCB-WeChat
原标题:《【学术前沿】李继喜/陈向军发现促炎性细胞死亡的全新调控机制》
