R-loop 是由一条RNA:DNA杂合链和一条单链DNA构成的三链核酸结构。它在转录调控、免疫球蛋白类别转换、端粒维持、DNA损伤以及损伤修复等过程中发挥重要作用。tRNA主要参与蛋白质的翻译合成,作为经典的非编码RNA,其被深入研究已有半个世纪之久。前期研究发现,R-loop在拟南芥中普遍存在,与大多数基因同时含有正义R-loop和反义R-loop不同,tRNA基因区富含正义R-loop。然而tRNA基因区R-loop的调控机制和相关的生物学功能仍然未知。
2021年09月01日,清华大学生命学院孙前文研究组在The Plant Cell的在线发表了题为Intragenic tRNA-promoted R-loops orchestrate transcription interference for plant oxidative stress responses的研究论文,揭示了基因内tRNA R-loops通过调控RNA聚合酶之间的转录干扰来调节植物对氧化胁迫的响应。


根据tRNA基因与其他基因(非tRNA基因)的相对位置,作者首先将tRNA 基因分为四类(图1A):第一类(TSS-300),处在转录起始位点上游300 bp 以内的tRNA基因;第二类(Intra),处在基因内的tRNA基因;第三类(TTS-300),处在转录终止位点下游300 bp以内的tRNA基因;第四类(Others),不属于前面三类的tRNA基因。通过分析R-loops水平,他们发现拟南芥基因内tRNA基因具有较高含量的正义R-loop(图1B),并且这种现象在人基因组中也是保守存在的(图1C)。
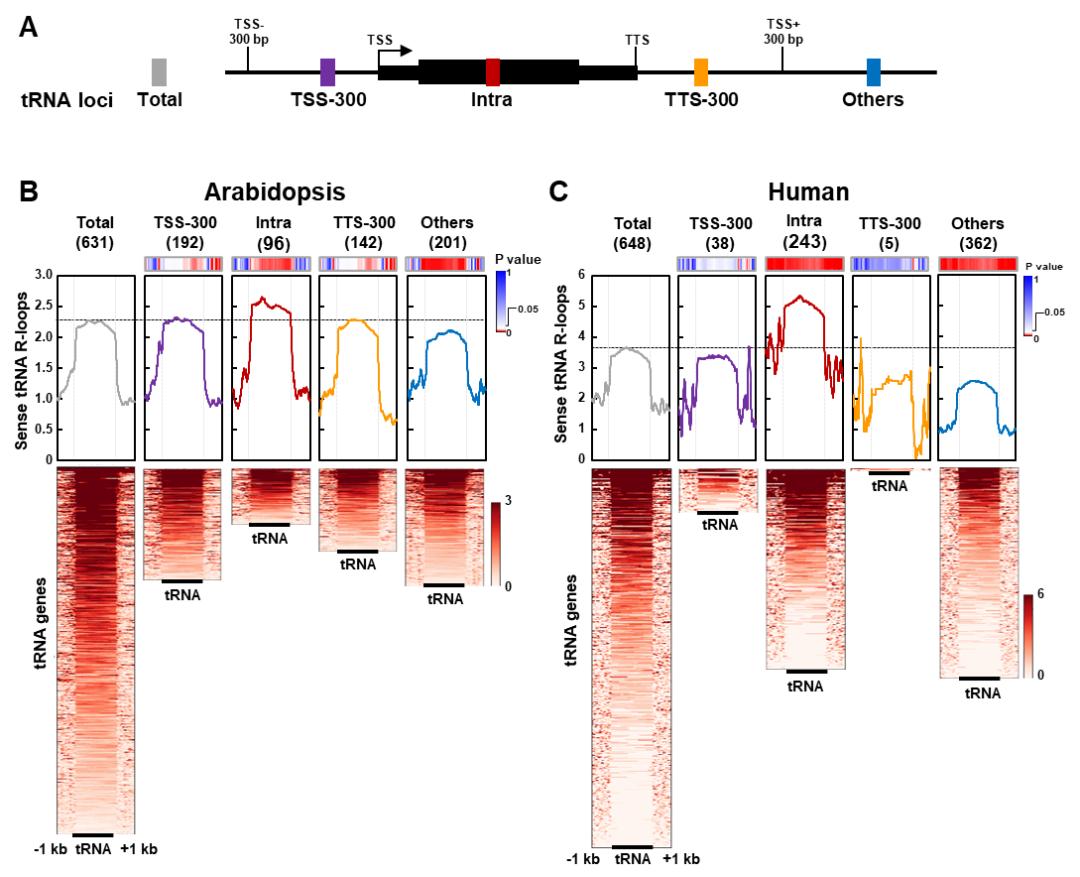
图1. 基因内tRNA基因具有较高丰度的正义R-loop
在拟南芥中,96个基因内tRNA散布在5条染色体上。tRNA基因是由RNAPIII转录的,而tRNA的宿主基因是由RNAPII转录的。免疫原位实验结果表明,处于转录延伸状态的RNAPII(RNAPIIS2P)和GFP-NRPC7在核质中存在共定位。在NRPC7(RNAPIII的一个特异亚基)弱突变nrpc7-1植物中,RNAPIIS2P在基因内tRNA宿主基因的结合增强;在nrpb2-3植物中或RNAPIIS2P抑制剂FLA处理后的植物中,NRPC7-GFP在基因内tRNA基因区的富集程度也增加。这些结果表明RNAPII和RNAPIII的转录活性在基因内tRNA区域相互干扰。
为了研究基因内tRNA对宿主基因表达的影响,作者利用RNA-seq检测了tRNA宿主基因的转录情况。分析发现在nrpc7-1中大部分tRNA宿主基因都表现出上调的趋势。接着作者选择三个代表基因(AtNUDX1、AT3G50840和AT3G01710)进行深入研究。利用原生质体瞬时表达系统和CRISPR/Cas9基因敲除技术研究发现基因内tRNA基因抑制宿主基因AtNUDX1和AT3G50840的表达。R-loops在基因内tRNA基因区富集,在nrpc7-1植物中,基因内tRNA形成的R-loops降低,宿主基因的表达增加。为了研究宿主基因的转录水平增加是否由基因内tRNA R-loops降低引起,作者构建了dCas9-RNH1系统,将无催化活性的Cas9蛋白(dCas9)与具有RNase H活性的植物RNase H1(AtRNH1C)融合,以实现特异位点R-loops的清除。此外,作者利用dCas9-dRNH1(dRNH1缺失切割RNA:DNA杂合链中RNA的催化活性,保留结合RNA:DNA杂合链的活性)作为对照。在转基因植物中,gRNA介导的dCas9-RNH1部分消除了AtNUDX1基因内的R-loops,AtNUDX1表达上调。gRNA介导的dCas9-dRNH1保护了AtNUDX1基因内的R-loops,导致AtNUDX1的表达被部分抑制。这些实验数据表明基因内tRNA R-loops抑制宿主基因的表达。
通过对48个tRNA宿主基因功能分析,作者发现这些基因主要参与DNA代谢和DNA损伤应答过程。在自然界中,植物生长时无法随意移动,因此它们受到来自不断变化的外部环境的胁迫。活性氧(ROS)是一种常见的胁迫因子,它可以氧化dGTP为8-ox-dGTP。 AtNUDX1编码8-ox-dGTP焦磷酸水解酶,负责消除拟南芥中的8-ox-dGTP。由于AtNUDX1在nrpc7-1中表达上调,作者选用百草枯(PQ)作为氧化剂分别处理野生型和nrpc7-1植物。与野生型植物相比,nrpc7-1植物表现出对PQ更强的耐受性,并且这种耐受部分依赖于AtNUDX1的表达上调(图2)。
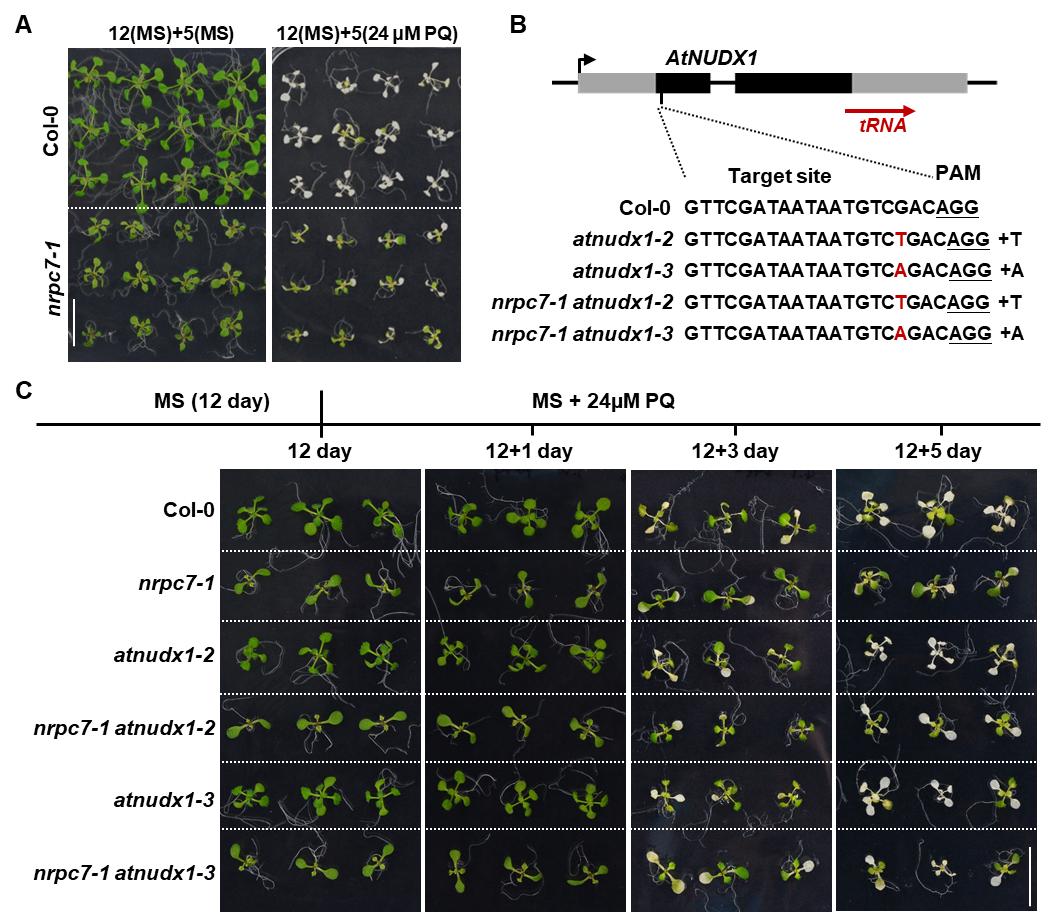
图2. tRNA 宿主基因AtNUDX1的表达上调促进植物对活性氧的耐受
综上所述,该研究揭示了基因内tRNA R-loops通过调控不同RNA聚合酶之间的转录干扰来调节tRNA宿主基因的表达。该研究一方面探究了tRNA基因区R-loops的功能及其生理意义;另一方面为tRNA基因介导的沉默 [tRNA gene–mediated (TGM) silencing] 机制提供了一种新的解释。此外,需要提及的是,孙前文实验室在之前的研究中揭示了另一类位于基因内的染色质结构,即内含子中的异染色质(intronic heterochromatin),参与抑制宿主基因的非正常转录起始的生物学功能(The Plant Journal, 2020)。
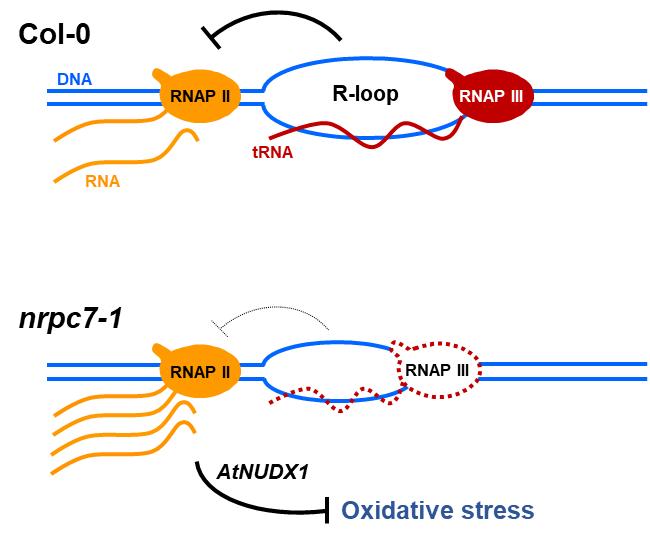
图3. 基因内tRNA 形成的R-loops参与调控RNA聚合酶II和III间的转录干扰
清华大学生命学院孙前文实验室博士后刘坤朋博士为论文的第一作者,孙前文研究员为通讯作者。该工作得到国家自然科学基金委、科技部国家重点研发计划以及生命科学联合中心等经费的支持。
本研究是孙前文研究组继报道一种精准、广谱、高效的全基因组R-loop检测新方法(Nature Plants 2017)、绘制拟南芥不同发育时期及环境刺激下的全基因组R-loops动态变化图谱(The Plant Cell, 2020)、合作发现OsTOP1共转录去除R-loops的效率会影响水稻根发育和向地性生长 (Molecular Plant, 2017)、合作发现一个全新的R-loops阅读器ALBA蛋白复合体,可以特异识别植物基因组中的大部分genic R-loops(Science Advances, 2019)等细胞核基因组R-loop的工作后,通过深入解析核基因组中一类全新的R-loops(基因内tRNA形成的R-loops),发现其调控RNA聚合酶之间的转录干扰从而应对植物氧化胁迫。
R-loop也在植物半自主细胞器如叶绿体和线粒体中发挥功能。孙前文实验室在半自主细胞器R-loop生物学功能和调控机制亦有一系列研究工作,包括AtRNH1C与RHON1调控转录-复制正面对撞、AtRNH1C与单链DNA结合蛋白WHY1/3和重组酶RecA1在拟南芥叶绿体中协作完成DNA损伤修复、发现了一种叶绿体和线粒体信息交换的新机制以保证线粒体基因组的完整性和早期胚胎发育的正常进行等(The Plant Cell 2017; Cell Reports 2020; Nucleic Acids Research 2021; PLOS Biology, 2021)。
孙前文实验室长期招收博士后 (招聘 | 清华大学孙前文实验室招聘博士后),欢迎对R-loops与基因组调控方向感兴趣的应(往)届博士毕业生申请。
论文链接:
https://doi.org/10.1093/plcell/koab220
来源:BioArt植物
#扫码关注我们#
网站:www.cscb.org.cn
微信:CSCB-WeChat:,。视频小程序赞,轻点两下取消赞在看,轻点两下取消在看
原标题:《【学术前沿】清华大学孙前文研究组发现基因内tRNA形成的R-loops调节植物的氧化胁迫响应》
