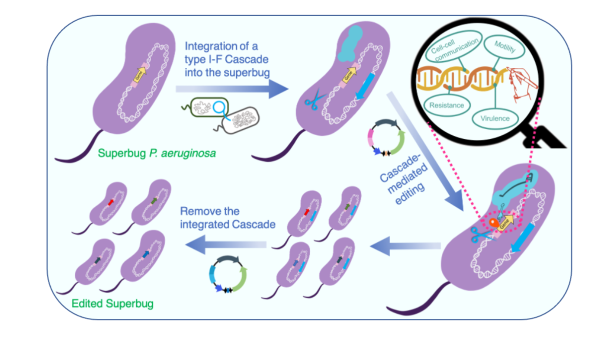
 利用可转移 I 型 CRISPR Cascade 技术编辑超级细菌铜绿假单胞菌的的策略和流程。
利用可转移 I 型 CRISPR Cascade 技术编辑超级细菌铜绿假单胞菌的的策略和流程。
(原新闻稿已于7月22日发布)
由香港大学(港大)理学院分子及细胞生物学研究部副教授闫爱新博士带领的研究团队,联合港大李嘉诚医学院微生物学系名誉临床教授胡钊逸共同进行的研究,开发了一个可转移和整合、基于 I 型 CRISPR-Cas 的基因编辑技术。该技术可以高效编辑超级细菌铜绿假单胞菌(Pseudomonas aeruginosa), 并加速鉴定多重耐药 (MDR) 病原体耐药决定因素和开发新型抗耐药的策略。铜绿假单胞菌是一种广泛存在的超级细菌,可以感染多个器官和组织,并且是造成院内感染的主要病原体。该研究不仅为 「非模式」细菌(例如直接从临床和环境分离的和形成人类微生物组的细菌)建立基因组编辑技术开辟了一条新途径,亦为扩展新型CRISPR-Cas技术提供框架。该研究现已于国际领先的科学期刊《核酸研究》(Nucleic Acids Research)发表。
研究背景
CRISPR-Cas 是原核生物中的适应性免疫系统,它通过切割病毒的 DNA 来解除入侵病毒的威胁。由于其独特的靶向和改变 DNA 序列的能力,CRISPR-Cas 被用作下一代基因组编辑方法;其中基于 2 类 II 型 的CRISPR/Cas9 系统的基因组编辑方法,彻底改变了大量模式生物的遗传操作方法而获得了 2020 年诺贝尔化学奖。然而,2 类 II 型的CRISPR-Cas 系统仅占原核生物中自然编码的 CRISPR-Cas 系统的约 10%,它们在编辑细菌基因组方面的应用相当有限。
随着测序技术和生物信息学的发展,属于不同类别和类型的 CRISPR-Cas新亚型不断被鉴定,它们是扩展基于 CRISPR 技术的原料库。其中,自然界中分布最广和最多样化的 CRISPR-Cas 系统是 1 类I 型系统,占已鉴定的所有 CRISPR-Cas 系统的 50%,并且具有 2 类CRISPR-Cas系统无法具备的独特优势,比如极低的脱靶效应、可以实现大片段DNA移除等。然而,I 型 CRISPR-Cas 系统依赖于称为 Cascade 的多组分效应复合物来干扰 DNA,这类复合物不易转移到异源宿主,限制了这些天然丰富的 CRISPR 系统在基因组编辑和疾病治疗中的广泛应用。
主要发现
在此之前,该团队在从玛丽医院一个血流感染病例中分离的一株耐多药铜绿假单胞菌PA154197中,鉴定出一个高活性的I-F型CRISPR-Cas系统。团队为CRISPR-Cas 系统进行分析,并在其基础之上,成功开发了一种基于内源性 I-F CRISPR-Cas 系统、适用于 PA154197分离株的基因组编辑方法。该方法能够加快鉴定出临床分离的耐多药铜绿假单胞菌中的耐药性决定因素,和加速开发新的抗耐药策略的步伐(Cell Reports, 2019, 29, 1707-1717)。
为了克服将复杂的 I-F 型 Cascade 转移到异源宿主的障碍,团队将整个 I-F 型 Cas 操纵子(Operon)复制到高效整合型载体 mini-CTX 中,并通过细菌间「接合」的方法,一种自然界微生物常用的 DNA 转移方法,将复合物传递到异源宿主基因组中保守的 attB 基因位点上,从而使它们拥有可以稳定表达和发挥功能的「内源性」 I-F 型CRISPR-Cas 系统。研究表明,与可转移 Cas9 系统相比,可转移I-F型 Cascade 显示出更强的 DNA 干扰能力和更高的稳定性,可在耐药铜绿假单胞菌中实现高效 (>80%) 和简便的基因组编辑,即通过一步转化单个质粒实现基因编辑。
在此基础之上,他们还开发了一种更先进的可转移系统。该系统既包括高活性型 I-F 系统,又同时包括了一个重组酶,因而可以在同源重组能力差的菌株、没有基因组序列信息的野生铜绿假单胞菌分离株,以及其他假单胞菌中实现一步法的基因编辑。最后,引入的 I-F 级联基因可以通过 I-F 级联介导的大 DNA 片段删除法从宿主基因组中轻松去除,从而在宿主细胞中进行无疤痕基因组编辑。此外,研究团队还展示了可转移系统在基因抑制中的应用,显示了可转移 I-F CRISPR 系统的强大和多样化的应用。
闫爱新博士表示,希望可运用此技术编辑病原菌,还可以改造益生菌,进而为治疗耐药菌引起的感染和促进人类健康发挥巨大作用:「运用此技术研发出的科技和医疗方法,为对抗超级病菌带来新希望。」
有关研究团队
本研究由港大理学院生物科学学院及分子及细胞生物学研究部副教授闫爱新带领,华南农业大学徐泽凌博士为第一作者(曾为港大理学院生物科学学院及分子及细胞生物学研究部博士后研究员)。其他研究人员包括港大李嘉诚医学院微生物学系名誉临床教授胡钊逸教授和曹慧荦博士、曲阜师范大学副教授司美茹,及港大理学院生物科学学院及分子及细胞生物学研究部博士生李嫣然和张光明。
研究由香港研究资助局和香港特别行政区食物及卫生局医疗卫生研究基金及香港大学基础研究种子基金资助。
有关闫爱新研究小组的相关资料:http://www.hku.hk/biosch/staff/ay/index.html
论文连结 :https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkab521/6307906
相片下载:https://www.scifac.hku.hk/press
