
叉头盒转录因子 (Forkhead box transcription factors, FTFs) 构成了一个高度保守的蛋白质家族,该家族蛋白都拥有能结合特定基因组DNA的叉头结构域(Forkhead domain)。通过介导转录的激活和抑制,以及与多种辅助因子的相互作用,FTFs参与了多种的细胞过程,包括细胞分化、代谢、细胞周期进程、凋亡和自噬,以及对细胞应激的保护。在发育过程中,FTFs通过多种机制调节组织形成和稳态。因此,特定FTFs的表达可以引导不可逆的细胞命运决定。FTFs在哺乳动物的发育和疾病中起着重要作用。然而,它们在小鼠体细胞重编程中的作用尚不清楚。
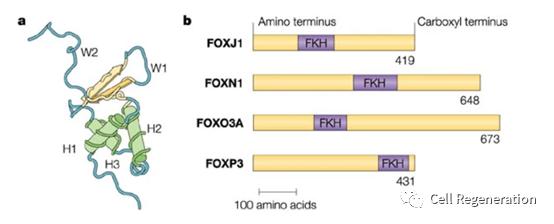
图1 各种FOX因子的叉头DNA结合域(FKH)的位置示意图。这些蛋白质是根据结构而不是功能分类的,而且DNA结合域的位置可以不同。
2021年7月2日,广州生物医药与健康研究院裴端卿,刘晶,曹尚涛研究员,在Cell Regeneration在线发表题为“Forkhead box family transcription factors as versatile regulators for cellular reprogramming to pluripotency”的研究文章。文章报道了FoxD亚家族和FoxG1可以促进小鼠成纤维细胞诱导多能干细胞(iPSCs)的产生。更重要的是FoxD3、FoxD4和FoxG1可以分别替代Oct4,与Sox2和Klf4一起通过种系传递产生iPSCs。相反,FoxO6通过抑制细胞增殖、抑制多能基因的表达、阻碍间充质细胞向上皮细胞转化(MET)的过程,几乎完全阻断了重编程。
首先,为了深入了解Fox基因在多能性中可能发挥的作用,作者分析了Fox转录因子家族成员在小鼠胚胎成纤维细胞(MEF)、小鼠胚胎干细胞(mESCs)、体细胞重编程和小鼠早期胚胎发育中的表达。结果显示,它们的差异很大,表明这些基因可能在多能性诱导中发挥不同的作用。为了验证这一假设,作者克隆了Fox转录因子家族的所有成员,并将它们单独转导到MEF中,结果显示Fox转录因子家族成员在小鼠体细胞重编程中发挥了不同的作用,其中FoxD3、FoxD4和FoxG1取代了Oct4并促进了iPSCs的生成。
随后, 作者为了验证KS FoxD3/FoxD4/FoxG1重编程诱导多能干细胞是否具有全多能性,进行了体外和体内实验。研究发现KS FoxD3/FoxD4/FoxG1重编程的iPSCs可以稳定传代,并保持了较强的Oct4表达。此外,基因组PCR插入分析显示,KSFoxD3、KSFoxD4和KSFoxG1诱导多能干细胞未融合Oct4转基因基因。这些诱导多能干细胞还表达了多能标记物,如Oct4、Nanog、Sox2、Dappa5a、Sall4和Rex1。KSFoxD3诱导多能干细胞在移入NOD SCID小鼠1个月后,具有正常的核型,发展为具有三个胚层组织的畸胎瘤。将KSFoxD3诱导多能干细胞注射到ICR小鼠的囊胚中,获得了嵌合小鼠的种系传递。总之,结果表明,KSFoxD3、KSFoxD4和KSFoxG1诱导多能干细胞集落类似于小鼠ESCs,并具有完全的多能性。
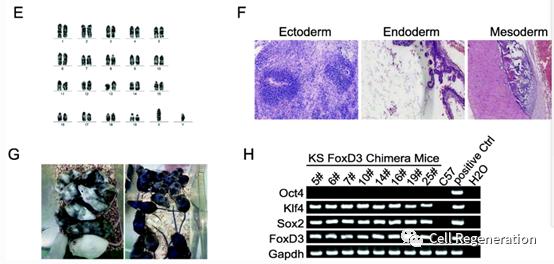
图2 KSFoxD3诱导多能干细胞在移入NOD SCID小鼠1个月后,具有正常的核型,发展为具有三个胚层组织的畸胎瘤。
Fox转录因子中,FoxO6对重编程的阻碍最为显著。为了探索FoxO6是如何抑制多能性诱导的。通过对重编程过程中细胞形态学变化的观察,作者推测FoxO6可能抑制了体细胞重编程早期的细胞增殖和间充质向上皮细胞转化(MET)过程。作者研究发现FoxO6在OKS介导的重编程过程中抑制了细胞增殖并且FoxO6抑制了Cdh1、Epcam等上皮基因的上调,并抑制了Oct4、Nanog、Esrrb和Dppa5a等多能基因的激活。为了弄清楚Forkhead DNA结合结构域哪个部分在基因重编程中起关键作用。作者构建了一系列FoxO6的截断,并在重编程中检查它们的功能。结果显示,FoxO6的各个结构域对重编程的抑制作用各不相同,其中FoxO6全长的抑制作用最为明显,说明FoxO6对重编程的抑制作用依赖于这三个功能域。
为了进一步研究FoxO6抑制体细胞重编程的机制,通过转录组分析,发现FoxO6可能延缓了重编程过程和促进细胞自噬过程,抑制细胞周期基因表达。相反,根据GO分析发现FoxO6倾向于激活一些表观抑制因子进行重编程,如HDAC9、小GTPase介导的信号转导和ERK通路,但抑制干细胞群体维持、干扰素- β和Wnt通路。综上所述,FoxO6主要通过抑制MET过程、多能基因激活和细胞增殖来抑制而不是延缓重编程。此外,FoxO6在细胞命运决定中的新功能可能与表观遗传调控、ERK、WNT、small GTPase等信号通路有关。

作者简介:
裴端卿 博士
中国科学院广州生物医药与健康研究院,西湖大学研究员;主要研究细胞命运调控。
Forkhead box family transcription factors as versatile regulators for cellular reprogramming to pluripotency | Cell Regeneration | Full Text (springeropen.com)
2019年,《细胞再生》(Cell Regeneration)经过了编辑队伍和期刊方向调整等大动作后,再度出现在学界同仁的视线中。该杂志是中国细胞生物学学会的官方出版物,采取开放获取(OA)的出版模式,在学会支持下目前不向作者收取发表费用(APC);致力于促进领域内科学家发表研究成果、交流科研心得,助力推动细胞再生的基础研究及其向临床的转化。
2020年,中国细胞生物学学会携手SpringerOpen共同出版《细胞再生》,共同打造高质量的出版平台,为广大作者和读者提供更好的服务。
来源:Cell Regeneration
原标题:《【学术前沿】裴端卿/刘晶/曹尚涛等揭示叉头盒家族转录因子作为细胞重编程多能性的调节因子》
