原创 生物世界 生物世界 收录于话题#帕金森病9#科学新知122
撰文 | xiao xia
编辑 | 王聪
排版 | 水成文
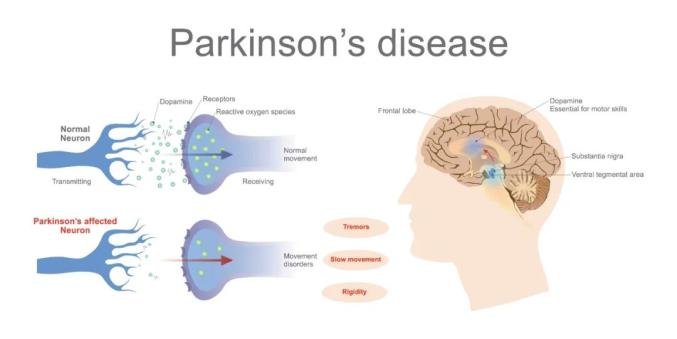
帕金森病(Parkinson’s Disease,PD),是一种复杂的神经退行性疾病,是最常见的中枢神经系统变性疾病之一,帕金森病的病因和发病机制仍不十分清楚,通常认为老龄化(Aging)、遗传(Genetics)和环境因素(Environment)及其相互作用参与了帕金森病的发生发展。
帕金森病是典型的神经退行性疾病,主要影响65岁以上的老年人群(发病率接近2%)。我国已全面进入老龄化社会,保守估计约有400万帕金森病患者,给人民健康与社会保障带来巨大负担。
由于多巴胺能神经元的丧失,帕金森病(PD)患者表现出运动功能障碍,这与致病性α-突触核蛋白聚集体和路易小体有关。随着 PD 的进展,这些聚集体会堆积在大脑区域从而导致痴呆。已经确定了几种与家族性 PD 相关的基因突变,然而,家族性 PD 仅占所有 PD 病例的大约 5%,散发性PD(sPD)的病因仍然未知。
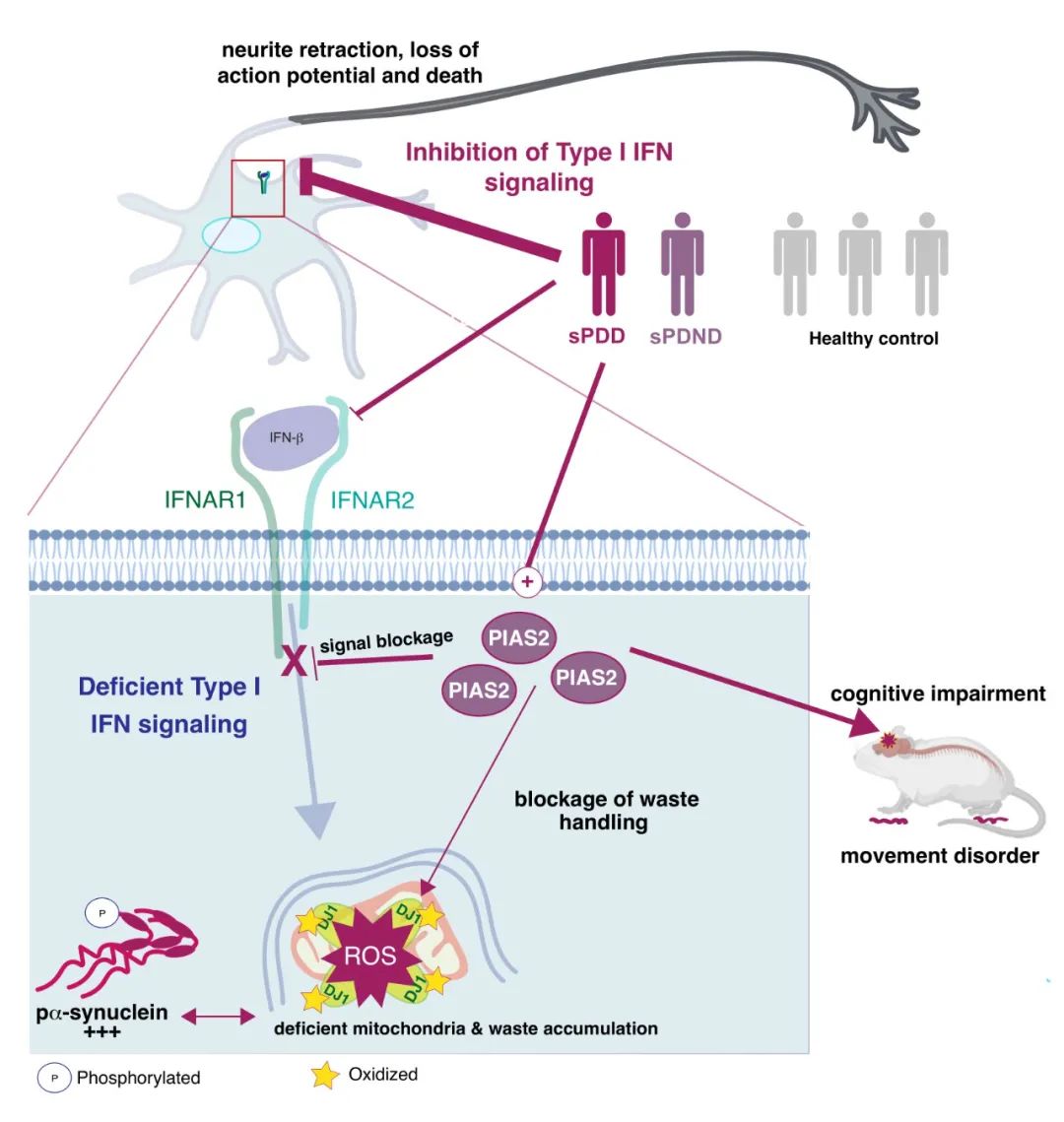
已经报道了功能性干扰素-β ( Ifnb ) 或其受体干扰素-α/β 受体 ( Ifnar ) 的缺乏导致类似 PD 的病理和行为。神经外胚层细胞不存在Ifnar,Ifnb是一种 I 型干扰素和免疫调节细胞因子,参与先天抗病毒免疫防御并调节神经炎症。PD 的进展与神经炎症有关,包括常驻小胶质细胞和星形胶质细胞的激活,这会加剧疾病晚期的病理。然而,尚未确定Ifnb信号在 sPD 患者的神经变性和神经炎症中的功能。
2021年7月8日,丹麦哥本哈根大学的研究团队在 Molecular Psychiatry 期刊发表了题为:PIAS2-mediated blockade of IFN-β signaling: a basis for sporadic Parkinson disease dementia 的研究论文。
该研究表明,占据帕金森病病例超过90%的散发性帕金森病(sPD),是由调节神经细胞动力源线粒体的通路阻塞引起的。阻塞导致大量受损线粒体积累,无法为细胞产生足够能量,进而导致神经元逐渐死亡,最终导致帕金森病症状。
更重要的是,该研究确定了散发性帕金森病(sPD)患者中的关键基因突变 PIAS2,证实了JAK-STAT2-PIAS2 通路的调节对于轴突生长与神经元存活和兴奋至关重要。因此,该通路有望作为治疗靶点。

研究团队结合并分析了四个GSEA数据集,这些数据集来自帕金森病患者和健康对照。他们研究了帕金森病患者的哪些基因模式受到干扰,尤其是那些患有痴呆症的帕金森病患者。他们发现细胞因子-细胞因子受体相互作用通路受到显著调节,强调了其在 PD 中的重要性。
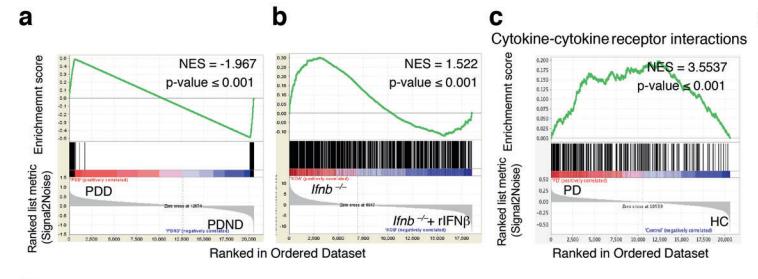
为了验证这些结果,他们从一个单独的sPD患者和健康对照的内部队列中检测了细胞因子-细胞因子受体相互作用途径中指定基因的表达情况。
在sPDD(痴呆)患者中,IFNG、IFNGR1和STAT4高度失调。证实了细胞因子信号失调与帕金森病进展为痴呆症相关。细胞因子-细胞因子受体和JAK-STAT信号通路都包含几种 I 型干扰素--IFNAs 、IFNB1和 IFNAR以及下游分子如 JAKs、STAT2 和PIAS2。
为了确定有缺陷的神经元 IFNβ-IFNAR 信号与 PD 的相关性,研究团队生成了一个常见的 I 型 IFN 基因特征, 并将其与 GSEA 数据集进行了比较。
结果显示,这一通路的负调节因子PIAS2,IFNAR1,JAK和STAT在sPDD患者的神经元中上调,表明IFNβ-IFNAR信号通路整体被阻断。
为了确定IFNβ-IFNAR信号中的基因序列变异是否与sPD相关,研究团队分析了包括上万例PD病例和对照的GWAS数据集,确定了43个与sPD患者相关的显著序列变异,其中,PIAS2相关的序列变异达到54个。此外,sPDD患者在神经元中表达较高水平的PIAS2 mRNA和蛋白。
这些发现促使他们研究 PIAS2 如何影响 PD 的临床和病理--特别是与痴呆进展相关的认知功能。
为了确定PIAS2在大脑中的功能,他们在小鼠大脑中单独或与人α-突触核蛋白一起在神经元启动子下过表达PIAS2,这导致小鼠运动和认知损伤,并与神经内磷酸化(p)α-突触核蛋白积累和多巴胺能神经元丢失相关。
进一步研究发现,神经元PIAS2的异位表达阻断了有丝分裂吞噬,增加了衰老线粒体和氧化应激的积累。相反,PIAS2基因敲除在恢复线粒体内稳态、氧化应激和pERK1/2-pP53信号通路,挽救了Ifnb–/–小鼠PDD的临床病理表现。
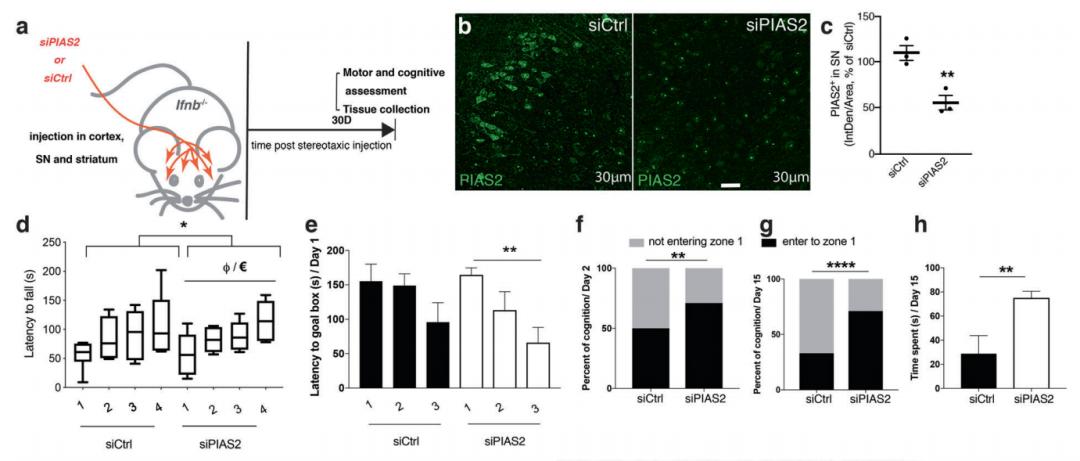
因此,该研究结果意味着 PIAS2 的失调会在多个水平上针对一系列信号蛋白促进帕金森病发展,这些蛋白的多方面功能汇聚在一起以破坏神经元稳态和功能。该发现有望使 PIAS2 成为未来治疗帕金森病的新靶标。
论文链接:
https://www.nature.com/articles/s41380-021-01207-w
