原创 奇含 医学界内分泌频道
*仅供医学专业人士阅读参考
1型糖尿病患者注射3针“疫苗”有望改变免疫防御
瑞典Linköping大学的研究团队近期在Diabetes Care杂志上发表的一项临床2b期随机双盲试验结果表明,1型糖尿病患者注射3针“疫苗”有望改变免疫防御,维持机体自身产生的胰岛素[1]。

01
为什么要竭尽全力保护残存的胰岛β细胞功能
1型糖尿病是一种T细胞介导的针对胰岛β细胞的自身免疫性疾病。
谷氨酸脱羧酶65KD亚基 (GAD65)、胰岛素、谷胰岛细胞瘤相关抗原2和锌转移蛋白8等自身抗原可以促使机体发动免疫攻击,进而选择性地破坏胰岛β细胞,导致胰岛素分泌绝对不足而发病。随着病程的进展,患者的胰岛β细胞将会被破坏殆尽从而迫使机体停止分泌内源性胰岛素,引起失控的高血糖和低血糖交替状态,并导致糖尿病酮症酸中毒、低血糖昏迷等一系列的急慢性并发症严重威胁患者的生命,缩短人们的预期寿命。
缺乏有效治疗手段的1型糖尿病迫使我们不得不从管理和保护残留的胰岛β细胞功能角度出发。研究发现,哪怕是极少的胰岛β细胞残存都能大幅降低患者的高血糖和低血糖的发生率,减少急慢性并发症的发生率和死亡率[2]。
02
GAD65抗原带来的新“希望”
研究人员指出,自身抗原可以通过诱导免疫耐受来治疗1型糖尿病[3]。GAD65治疗新诊断的1型糖尿病的临床获益不同研究的结论不尽相同[4,5]。为了进一步明确注射 GAD65 是否可以保护1型糖尿病患者的胰岛功能,研究者们进行了以下试验。
方法:研究纳入了109名年龄在12-24岁,病程7-193天,血清GAD65自身抗体阳性、空腹血清C肽>0.12 nmol/L的1型糖尿病患者,将其随机分配至试验组和对照组。
试验组每月将接受一次GAD65注射治疗,总计3次。同时需口服维生素D(每天2000 IE,持续120天)。
对照组仅接受安慰剂治疗,时长剂量都与试验组保持一致。
主要指标:对比基线及治疗后两组的C 肽刺激分泌情况(平均曲线下面积,AUC)。
结果:在GAD65 治疗15个月后,试验组和对照组的血清C肽分泌情况没有显著差异(治疗效果比:1.091,95%CI :0.845–1.408,P = 0.5009,见图 A)。然而,对于携带 HLA DR3-DQ2 基因的1型糖尿病患者,试验组(n = 29)的C 肽AUC 比对照组( n = 17)高出55.7%(治疗效果比:1.557, 95%CI:1.126–2.153,P = 0.0078,见图 B) 。
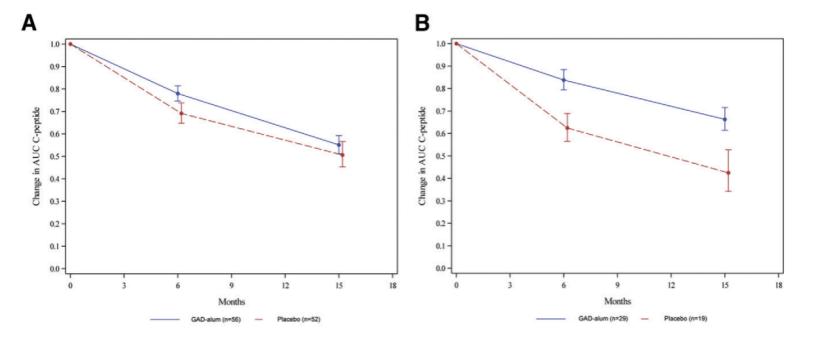
那为什么对HLA DR3-DQ2基因型有效?
携带某些特殊的人类白细胞抗原(HLA)基因,比如HLA-DR3-DQ2,的人更易患1型糖尿病。因为GAD65将更易被暴露在这些人的胰岛β细胞表面,免疫系统更易受此刺激生成对抗该蛋白质的抗体,连累β细胞备受攻击。正是因为这类基因型的发病机制和GAD65直接相关,其可以从GAD65诱导的免疫耐受中获益。
03
免疫治疗是1型糖尿病防治的一个重要赛道
目前1型糖尿病的治疗主要手段是胰岛素,然而在此之前,也有许多关于1型糖尿病患者的免疫治疗的研究。
其中一个主要的治疗方向是针对自身免疫性抗体。已经进行过研究的药物包括抗 CD3 单克隆抗体 (teplizumab)[6,7]、肿瘤坏死因子-a抑制剂[8]、ATG[9]、alefacept[10]和利妥昔单抗[11]等,其中一些研究也显示出令人鼓舞的的疗效,但这些疗法或因为严重的不良反应,或因为沉重的治疗负担并不能适用于临床。
另一个研究方向是通过自身抗原调节免疫系统。但是大多数自身抗原免疫疗法没有达到满意的治疗效果,这可能与1型糖尿病的异质性有关[12]。还有研究证实,CD3 单克隆抗体teplizumab能延迟1型糖尿病发病长达2年时间甚至更久[13]。
总而言之,虽然该研究未能发现携带GAD抗体阳性的1型糖尿病患者能否从GAD65治疗中获益,但是它还是取得了一定的突破性进展,以此可以证实GAD65治疗对于HLA-DR3-DQ2基因型的1型糖尿病患者有效。这提示未来研究者应该更关注患者的异质性。无论如何,基于1型糖尿病的发病机制,免疫治疗还是未来预防和治疗1型糖尿病的希望!
参考文献:
[1]Ludvigsson, J., Sumnik, Z., Pelikanova, T., Chavez, L. N., Lundberg, E., Rica, I., ... & Casas, R. (2021). Intralymphatic Glutamic Acid Decarboxylase With Vitamin D Supplementation in Recent-Onset Type 1 Diabetes: A Double-Blind, Randomized, Placebo-Controlled Phase IIb Trial. Diabetes Care.
[2]Ludvigsson J. The clinical potential of lowlevel C-peptide secretion. Expert Rev Mol
Diagn 2016 16:933–940
[3]Ludvigsson J. Adequate doses of autoantigen administered using the appropriate route may create tolerance and stop autoimmunity. Diabetologia 2009;52:175-176
[4]Ludvigsson J, Faresjo M, Hjorth M, et al. GAD treatment and insulin secretion in recent-onset type 1 diabetes. N Engl J Med 2008;359:1909-1920
[5]Wherrett DK, Bundy B, Becker DJ, et al. Antigen-based therapy with glutamic acid decarboxylase (GAD) vaccine in patients with recent-onset type 1 diabetes: a randomised double-blind trial. Lancet 2011;378:319-327
[6]Herold KC, Hagopian W, Auger JA, et al.Anti-CD3 monoclonal antibody in new-onset type 1 diabetes mellitus. N Engl J Med. 2002;346:1692–1698
[7]Sherry N, Hagopian W, Ludvigsson J, et al.; Prot eg e Trial Investigators. Teplizumab for treatment of type 1 diabetes (Prot eg e study): 1-year results from a randomised, placebocontrolled trial. Lancet 2011;378:487–497
[8]Quattrin T, Haller MJ, Steck AK, et al.; T1GER Study Investigators. Golimumab and beta-cell function in youth with new-onset type 1 diabetes. N Engl J Med 2020;383:2007–2017
[9]Haller MJ, Schatz DA, Skyler JS, et al.; Type 1 Diabetes TrialNet ATG-GCSF Study Group. Low-dose anti-thymocyte globulin (ATG) preserves b-cell function and improves HbA1c in new-onset type 1 diabetes. Diabetes Care 2018;41:1917–1925
[10]Rigby MR, Harris KM, Pinckney A, et al. Alefacept provides sustained clinical and immunological effects in new-onset type 1 diabetes patients. J Clin Invest 2015;125:3285–3296
[11]Pescovitz MD, Greenbaum CJ, KrauseSteinrauf H, et al.; Type 1 Diabetes TrialNet AntiCD20 Study Group. Rituximab, B-lymphocyte depletion, and preservation of beta-cell function. N Engl J Med 2009;361:2143–2152
[12]Krischer JP, Lynch KF, Lernmark Å, et al.;TEDDY Study Group. Genetic and environmental interactions modify the risk of diabetes-related autoimmunity by 6 years of age: the TEDDY study. Diabetes Care 2017;40:1194–1202
[13]Kevan C. Herold, et al., (2019). An Anti-CD3 Antibody, Teplizumab, in Relatives at Risk for Type 1 Diabetes. N Engl J Med, 10.1056/NEJMoa1902226.
本文首发丨医学界内分泌频道
本文作者丨含笑
责任编辑丨曹前
版权申明
本文原创,如需转载请联系授权
-End-
