RLR (RIG-I-like receptor) 信号通路是固有免疫系统中清除RNA病毒的关键信号通路。RLR信号通路的失活将导致一型干扰素等抗病毒细胞因子的产生不足,继而引发严重的感染;另一方面,其过度活化将导致持续性的炎症,组织损伤、自身免疫性疾病甚至危及生命。因此,研究RLR信号通路的正负调控因子及其具体调控机制对于充分了解、干预该信号通路并进而应用于临床十分重要。然而,参与调控该信号通路的重要因子及其机制仍有待挖掘。
而另一方面,作为“首度发现的一种可在人体中成为信号分子的气体”,一氧化氮(NO)在神经、心血管、肌肉、肝脏、免疫等系统起着关键作用,同时能自由通过细胞膜,因而调节NO的浓度和代谢在心血管疾病和肿瘤的防治、改善男性勃起障碍等方面有着广泛而重要的临床应用价值。Robert F Furchgott, Louis J Ignarro and Ferid Murad三位科学家也因为发现NO的重要作用而获得1998年的诺贝尔奖。
2021年4月13日,首都医科大学王玺教授研究团队领衔在Science Signaling杂志上发表题为DDAH2 suppresses RLR-MAVS-mediated innate antiviral immunity by stimulating nitric oxide-activated, Drp1-induced mitochondrial fission的文章。揭示二甲基精氨酸二甲胺水解酶DDAH2通过促进NO介导的线粒体片段化抑制抗病毒信号通路的传导。

定位于线粒体外膜的MAVS (mitochondrial antiviral-signaling, 亦称为IPS-1, Cardif, 或 VISA) 作为RLR信号通路中的关键接头蛋白,是多种调控因子的作用靶点。在此研究中,研究者首先通过蛋白质质谱鉴定与MAVS存在相互作用的蛋白,以此来挖掘MAVS以及RLR信号通路可能的调控因子。在鉴定到的众多MAVS相互作用蛋白中,研究者将目光聚焦于二甲基精氨酸二甲胺水解酶DDAH2 (dimethylarginine dimethylaminohydrolase 2), DDAH2通过水解NO合成酶的竞争性抑制剂L-NMMA (NG-monomethyl-L-arginine) 和ADMA (asymmetric dimethylarginine) 促进NO的生成,并在免疫组织中高表达,然而其在抗病毒免疫中的调控作用始终未知。
研究者在细胞和小鼠的RNA病毒感染模型中,均发现DDAH2的缺失可以促进RNA病毒感染时,RLR信号通路的激活以及一型干扰素β等细胞因子的产生,进而增强了小鼠的抗病毒免疫反应。由此,研究者发现并证明DDAH2为RLR信号通路介导的抗RNA病毒免疫反应的负调控因子。
随着机制研究的深入,研究者发现RNA病毒感染以及RLR信号通路激活并没有引起DDAH2表达水平的变化,而是促使DDAH2转位到线粒体,并引起线粒体片段化。进而使定位于线粒体外膜的MAVS无法依托线粒体形成功能性聚集体,无法向下游传递信号,从而解释了DDAH2在RLR信号通路传导过程中的负调控作用。
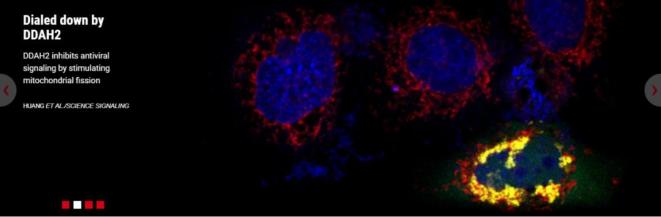
图1. RNA病毒感染后,DDAH2转位至线粒体,并引起线粒体片段化(绿色信号:Myc-DDAH2蛋白免疫荧光染色;红色信号:线粒体探针;黄色信号:Myc-DDAH2和线粒体共定位;蓝色信号:DAPI染色)。
接下来,研究者继续探究DDAH2引起线粒体片段化的具体机制。通过实验发现,RNA病毒感染过程中,DDAH2通过促进NO的产生,增强线粒体片段化执行者Drp1 (dynamin-related protein) 的磷酸化激活,进而促进线粒体分裂,并抑制MAVS向下游传递信号。此外,借由DDAH2,研究者发现在RNA病毒感染过程中,NO的产生对RLR信号通路的传导存在负调控作用。
此外,研究者还发现RLR信号通路中的激酶TBK1 (TANK-binding kinase 1) 可以磷酸化修饰DDAH2特定位点的氨基酸残基,从而抑制DDAH2对底物(NO合成酶竞争性抑制剂L-NMMA和ADMA) 的催化活性。被TBK1磷酸化修饰后,DDAH2无法促进NO产生以及Drp1介导的线粒体片段化,因此,无法抑制RLR信号通路的激活。这也是首次发现DDAH2可以被激酶磷酸化从而调控其功能,进而影响NO的代谢,有着深远的科学意义和临床应用价值。
综上所述,此项研究揭示了DDAH2在抗RNA病毒免疫反应中的重要作用,并以DDAH2为媒介,揭示RNA病毒感染时,DDAH2--NO信号通路和RLR--MAVS通路之间的相互调节作用,并揭示了一种在抗病毒免疫反应期间维持免疫稳态的机制。此外,由于RLR--MAVS和DDAH2--NO作为RNA病毒感染时普遍激活的两条十分重要的信号通路,相信此项研究也将为未来的COVID-19相关研究提供新的视角和思路。
黄珊博士、李泽兴博士、武泽文博士、刘畅博士为本文的共同第一作者,首都医科大学的王玺教授和山西省白求恩医院的张莉芸主任为共同通讯作者。
原文链接:
https://doi.org/10.1126/scisignal.abc7931
专家点评
高成江(山东大学基础医学院教授)
RLR-MAVS-TBK1信号通路在抵抗RNA病毒感染中发挥关键作用。RLR识别病毒的RNA分子后被活化,通过其N端CARD结构域与MAVS的CARD结构域结合,诱导MAVS在线粒体上形成prion-like结构,进而招募各种信号分子,活化下游的信号通路,诱导I型干扰素产生和抗病毒免疫反应。由于MAVS定位到线粒体上,因此调控线粒体动态过程例如分裂和融合将影响MAVS在线粒体上的聚集,进而影响抗病毒免疫反应,但调控线粒体动态过程的因素并不清楚。王玺领导的课题组通过质谱筛选发现,DDAH2(dimethylarginine dimethylaminohydrolase 2,二甲基精氨酸二甲胺水解酶2)作为MAVS的相互作用蛋白,在RNA病毒感染后可转位到线粒体,负向调控抗病毒免疫反应。DDAH2可水解N(G),N(G)-dimethyl-L-arginine (ADMA)和N(G)-monomethyl-L-arginine (MMA),ADMA和MMA是一氧化氮合成酶NOS的抑制剂,因此DDAH2可调控NO的生成。与此一致,作者发现病毒感染后,线粒体上NO生成增多,随后作者发现NO在线粒体上的富集,可激活线粒体分裂蛋白Drp1的磷酸化,导致线粒体分裂,进而抑制MAVS蛋白在线粒体上形成聚集体,从而抑制抗RNA病毒下游信号通路的活化和抗病毒免疫反应。特别有趣的是作者发现,病毒感染后通过RLR-MAVS-TBK1轴活化的TBK1,可磷酸化DDAH2,进而抑制DDAH2的酶活性、NO的生成、Drp1的活化和线粒体的分裂。因此DDAH2-ADMA-NO和RLR-MAVS-TBK1形成一个交互的反馈抑制环路,精细调控抗病毒天然免疫活化。NO是一个寿命短和可扩散的气体分子,NO如何调控Drp1的磷酸化,有待进一步研究;另外,细胞内主要有三种NOS:iNOS, eNOS和nNOS,DDAH2通过调控哪个NOS来增强线粒体NO的生成,也有待进一步阐明。总之,本研究发现了一条通过调控线粒体分裂而精细调控抗病毒天然免疫的分子通路,拓宽了对抗病毒天然免疫调控机制的认识,将为相关疾病的治疗提供了理论参考。
冯平辉(美国南加州大学Professor and Section Chair of Infection and Immunity)
在本研究中,王玺教授团队聚焦于先天性免疫系统抵抗RNA病毒入侵的RLR-MAVS信号通路,深入挖掘该信号通路的重要调控因子及机制进而探究该信号通路的精细调控。通过蛋白质亲和纯化及质谱分析,研究者们发现DDAH2是重要接头蛋白MAVS的全新相互作用蛋白。接下来,研究者们首先通过细胞及小鼠RNA病毒感染模型,发现并证实DDAH2为RLR-MAVS信号通路的负调控因子。随后的机制研究中,研究者们观察到RNA病毒感染时,DDAH2发生了向线粒体的转位,而蛋白质表达没有改变。有趣的是,随着DDAH2的转位,线粒体发生了明显的片段化,进而抑制了MAVS在线粒体上形成功能性聚集体以及下游信号的传递。随着研究的深入,研究者们发现,RNA病毒感染时,DDAH2可以通过水解一氧化氮合成酶的竞争性抑制剂 (L-NMMA和ADMA) 促进一氧化氮的产生,进而促进线粒体片段化执行者Drp1的磷酸化激活,致使线粒体发生片段化。此外,研究者们还发现RLR-MAVS信号通路中的激酶TBK1可以对DDAH2进行磷酸化修饰,从而抑制其对底物的催化活性以及一氧化氮的产生。通过此项研究,研究者们不仅揭示了DDAH2在抗病毒免疫中的重要作用,并且以DDAH2作为媒介,揭示了一氧化氮这一著名气体调节分子在RLR-MAVS信号通路以及抗RNA病毒免疫中的重要调节作用。
此外,王玺教授团队发现TBK1可以通过磷酸化修饰DDAH2从而调节其功能,这是迄今为止首次发现DDAH2的可调控性,这将为一氧化氮代谢和DDAH蛋白家族功能的相关研究领域开创新的视角和研究技术。同时,也为肿瘤、心血管疾病、男性勃起功能障碍等多种与一氧化氮代谢和DDAH蛋白家族功能异常相关的疾病提供新的药物靶点以及有效治疗策略。
胡小玉(清华大学教授)
王玺教授团队通过质谱发现与MAVS的新型互作蛋白DDAH2,于是决定研究DDAH2在抗病毒天然免疫中的作用。作者们在小鼠中敲除了Ddah2基因,观察到在基因敲除小鼠中RLR介导的抗病毒免疫反应显著增强,体现在IRF3磷酸化以及I型干扰素表达增加。分子机制层面,作者们捕捉到病毒感染细胞后DDAH2定位到了线粒体,并随后进行了一系列精细的生化实验,提示DDAH2通过促进NO的产生以及线粒体裂变从而影响MAVS 的多聚化,以达到抑制抗病毒免疫的功效。有意思的是,RLR通路下游的激酶TBK1可以磷酸化DDAH2并抑制其促进NO产生的能力,形成双向负反馈环路。这些结果发现了DDAH2在抗病毒天然免疫中的负向调节作用并深入阐述了其发挥功能的分子机制,提示DDAH2可能是机体内防止过度免疫激活的分子网络的一员。同时,通过阐述DDAH2的作用机制,作者们发现NO可能参与此负向调节环路,进一步研究精氨酸代谢产物与RLR介导的抗病毒通路之间的交互作用是非常有意义的方向。
参考文献
1. R. B. Seth, L. Sun, C.-K. Ea, Z. J. Chen, Identification and characterization of MAVS, a mitochondrial antiviral signaling protein that activates NF-KB and IRF3. Cell 122, 669–682 (2005).
2. T. Kawai, K. Takahashi, S. Sato, C. Coban, H. Kumar, H. Kato, K. J. Ishii, O. Takeuchi, S. Akira, IPS-1, an adaptor triggering RIG-I- and Mda5-mediated type I interferon induction. Nat. Immunol. 6, 981–988 (2005).
3. L. G. Xu, Y. Y. Wang, K. J. Han, L. Y. Li, Z. Zhai, H. B. Shu, VISA is an adapter protein required for virus-triggered IFN-b signaling. Mol. Cell 19, 727–740 (2005).
4. E. Meylan, J. Curran, K. Hofmann, D. Moradpour, M. Binder, R. Bartenschlager, J. Tschopp, Cardif is an adaptor protein in the RIG-I antiviral pathway and is targeted by hepatitis C virus. Nature 437, 1167–1172 (2005).
5. F. Hou, L. Sun, H. Zheng, B. Skaug, Q. X. Jiang, Z. J. Chen, MAVS forms functional prion-like aggregates to activate and propagate antiviral innate immune response. Cell 146, 448–461 (2011).
Https://www.nobelprize.org/prizes/medicine/1998/7543-the-nobel-prize-in-physiology-or-medicine-1998/
6. C. J. Lowenstein, S. H. Snyder, Nitric oxide, a novel biologic messenger. Cell 70(5):705-7 (1992),
7. T. B. Fonseca, A. Sanchez-Guerrero, I. Milosevic, N. Raimundo, Mitochondrial fission requires DRP1 but not dynamins. Nature 570, E34–E42 (2019).
本文转载自公众号“BioArt”(BioGossip)
中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
原标题:《【科技前沿】王玺团队发现一氧化氮代谢与经典抗病毒信号转导通路的调控反馈环》
