原创 Cell Press CellPress细胞科学

生命科学Life science
北京大学生命科学学院孔道春实验室研究真核细胞DNA复制、checkpoint调控维持DNA复制叉稳定、 chromsfork 调控与复制叉稳定及染色质结构形成、DNA同源重组、DNA双链断裂修复等的分子机制。该实验室主要科学发现:发现一个真核细胞DNA复制起始蛋白Sap1/Girdin,证明Sap1/Girdin是组装pre-replicative complex (pre-RC,由5个蛋白因子组成) 的一个必须因子;阐明了从裂殖酵母到人细胞的DNA复制源结构;确定岗崎片段加工机制;确定checkpoint调控Dna2核酸酶防止复制叉倒转;确定checkpoint调控复制解旋酶以维持复制叉稳定,此机制应该是该调控事件的重要机制(文章评审);发现一条新的细胞调控通路,命名为chromsfork control,chromsfork通过调控染色质结构来维持停顿DNA复制叉稳定;chromsfork调控染色质结构形成, 解决了染色质结构是怎么形成的这个120年的问题;发现Cdc24蛋白是裂殖酵母同源重组的一个必需因子;发现RNA polymerase III 是DNA同源重组的必需因子,确定DNA同源重组末端降解过程中3’-单链DNA的保护机制,并确定RNA-DNA hybrid是必需中间体。相关文章发表在Cell、PNAS、JBC等杂志。
2021年2月23日,北京大学生命科学学院孔道春实验室在Cell Press细胞出版社期刊Cell在线发表了题为“RNA polymerase III is required for the repair of DNA double-strand breaks by homologous recombination”的研究论文。该研究发现了DNA同源重组过程的一个必需中间体—RNA-DNA hybrid,及一个必需因子—RNA聚合酶III。
Cell Press细胞出版社微信公众号对该论文的作者团队进行了采访并对论文进行了解读,旨在与广大科研人员深入分享该研究成果以及一些未来的展望。
作为三大DNA代谢途径(DNA复制、重组、损伤修复)之一,DNA同源重组(Homologous Recombination)是生命体的基本生物事件。它在细胞生长、减数分裂、配子形成、物种进化、DNA双链断裂修复、基因组稳定性维持等多方面,起着必需作用。如图1显示,两条相似但不完全一致的姐妹染色体通过DNA同源重组进行遗传信息交换,以促进生命体进化。
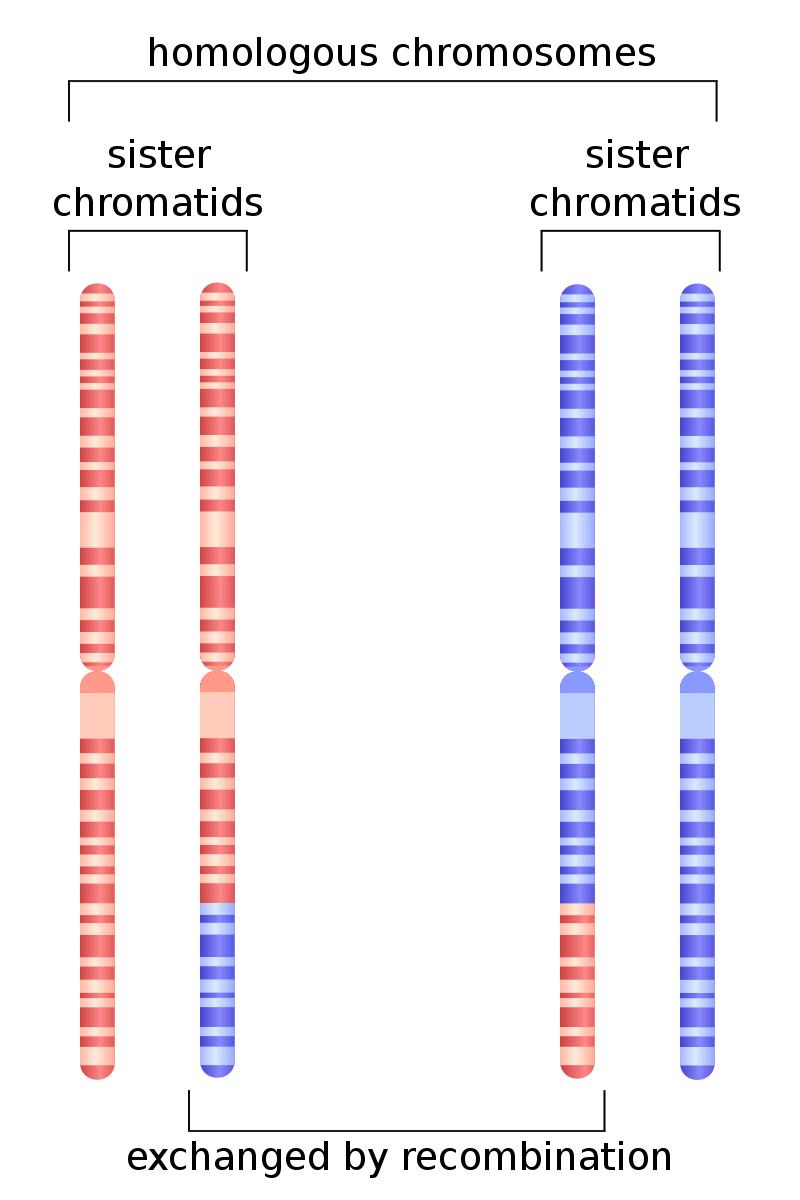
▲图1. 减数分裂期姐妹染色体重组
https://en.wikipedia.org/wiki/Homologous_recombination#/media/File:HR_in_meiosis.svg
DNA同源重组由三大主要步骤组成(图2):1)链末端切除(end resection):MRN-CtIP、DNA2、EXO1等核酸酶对DNA双链断裂(DNA double-strand break, DSB)处进行5’-链降解,切除大约几千个核苷酸,导致3’-单链DNA形成;2)3’-单链DNA入侵同源DNA模板链(strand invasion):通过多个蛋白帮助,Rad51包裹3’-单链DNA形成核酸-蛋白复合体,该复合体侵入同源DNA链,3’-单链DNA作为引物进行DNA合成;3)解开Holliday Junction(HJ)结构(resolution of Holliday Junction):3’-单链DNA侵入同源DNA模板链后,随后进行的DNA合成及链交换反应,导致HJ结构形成,相关核酸酶解开HJ结构,并最终完成DNA同源重组过程。
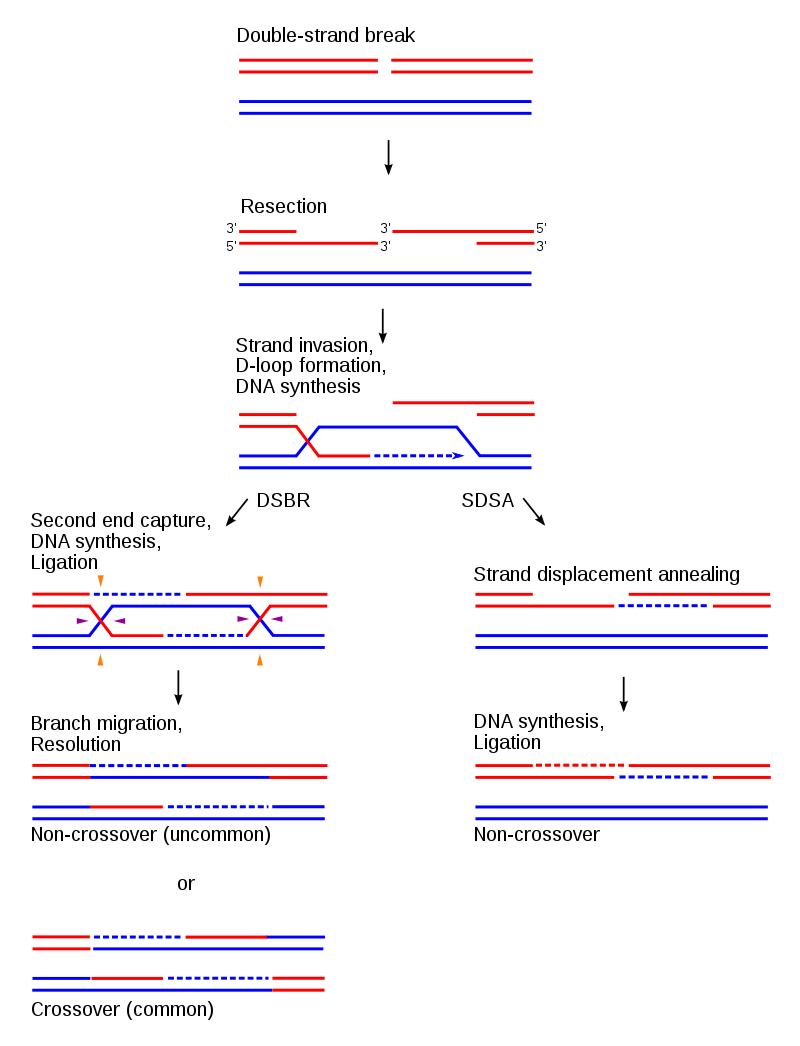
▲图2. 同源重组的一般过程
Sung P, Klein H (2006). "Mechanism of homologous recombination: mediators and helicases take on regulatory functions". Nature Reviews Molecular Cell Biology 7: 739-750.
DNA同源重组领域,有一个关键问题一直等待阐明:即细胞是如何进行末端切除5’-链的几千个核苷酸,但又保证3’-链的绝对完整。过去二三十年,一个普遍被认可或接受的观点是:3’-单链是通过RPA(replication protein A,a single-strand DNA binding complex)的结合来保护的。但是,此观点缺乏确切的实验证据。再进一步考虑,用蛋白结合的方式来保护几千个核苷酸长度的单链DNA,避免被核酸酶攻击,从理论上讲,这个可能性非常小,理由有三个:1)细胞如何能做到蛋白结合能早于核酸酶攻击;2)细胞如何能做到几千个核苷酸长度的每一个核苷酸都被蛋白覆盖而不留任何被核酸酶攻击的空隙;3)蛋白结合到DNA不可能是恒定的,有结合-脱离-再结合事件发生,蛋白一旦脱离DNA,核酸酶就得到了攻击DNA的机会。具体到此生物事件,我们不认为细胞能做到第一和第二点,第三点是客观现实存在。因此,我们认为细胞必定用其它机制来保护DNA断裂处的3’-单链DNA。
我们发现3’-单链DNA是通过形成暂时的RNA-DNA杂交链来得到保护,催化此RNA链合成的是RNA聚合酶III。因此,RNA聚合酶III是同源重组的一个必需因子,RNA-DNA杂交链是DNA同源重组事件的一个必需中间体,图3是DNA同源重组修正后的模型。RNA-DNA杂交链中间体的发现将推进真核细胞DNA同源重组领域里一系列长期悬而未决的问题的解决,并推进DNA同源重组事件分子机制的理解到一个新的层次;同时,将促进相关技术的开发,包括疾病的基因治疗、动植物物种的开发、抗癌药物的研发等。
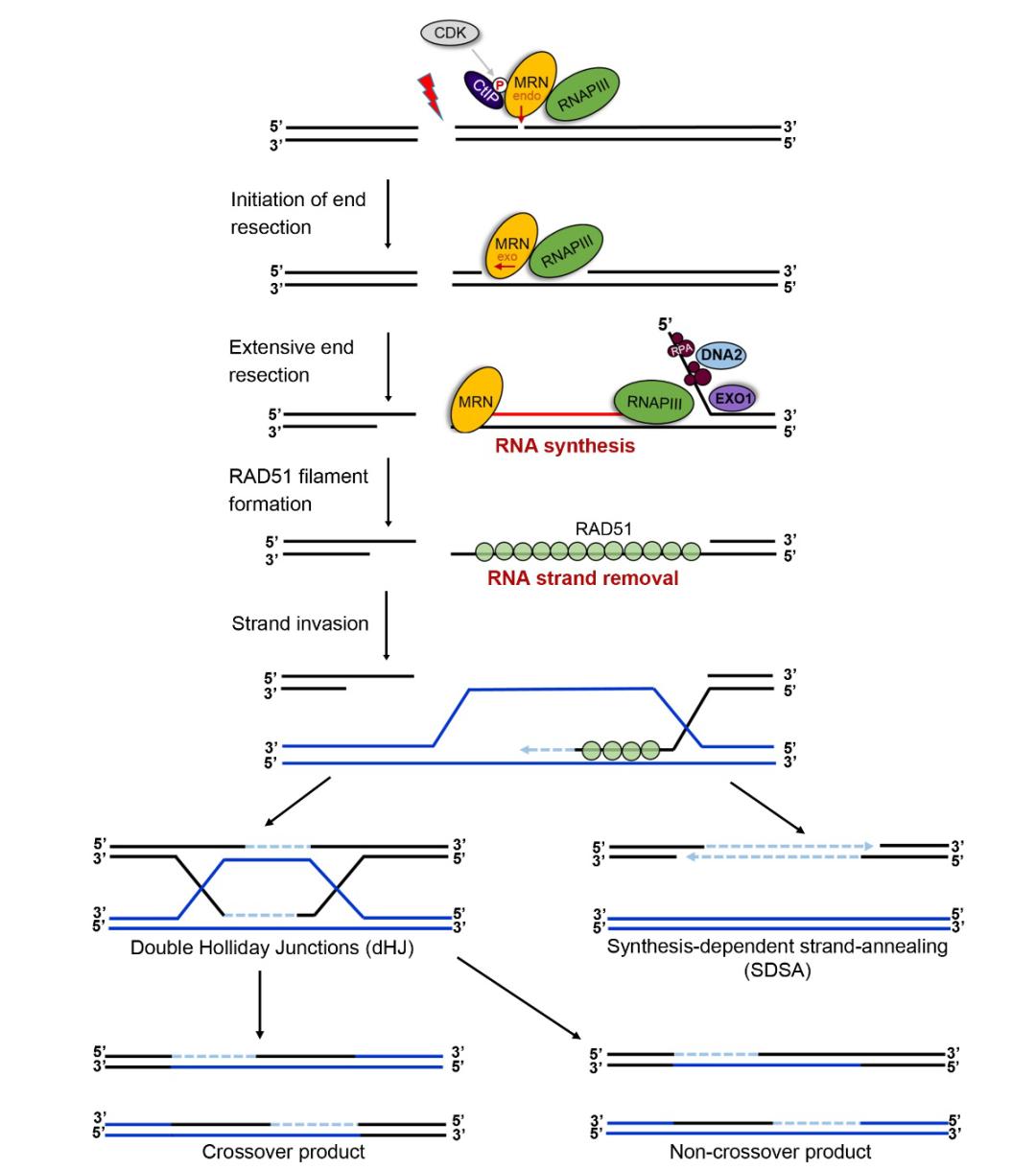
▲图3. 新的DNA同源重组模型。
北京大学生命科学学院孔道春教授为该论文的通讯作者。刘思杰博士、华余博士、王静娜副教授、以及孔道春实验室技术员李凌彦为该论文的共同第一作者。袁俊杰、张波、王子阳、纪建国教授也做了重要贡献,感谢实验室所有成员的帮助。本工作得到了北大-清华生命科学联合中心、科技部国家重点研发计划、国家自然科学基金委、蛋白质与植物基因研究国家重点实验室以及生命科学学院仪器中心(成像平台)的大力支持。
作者专访
Cell Press细胞出版社特别邀请论文通讯作者孔道春教授代表研究团队进行了专访,请他为大家进一步详细解读。
CellPress:请您为我们介绍一下本研究的背景和初衷是什么?
孔道春教授:DNA同源重组是生命体的基本生物事件,是遗传物质DNA代谢(DNA复制,重组,修复)的三种主要途径之一。它在细胞生长、减数分裂、配子形成、物种进化、DNA双链断裂修复、基因组稳定性维持等多方面,都起着必需作用。同时,如果DNA同源重组缺陷,将导致基因组极其不稳定,并引起各种疾病,包括癌症。利用DNA同源重组技术,可以进行动植物物种改造,也可以进行疾病的基因治疗。所以,阐明DNA同源重组的分子机制,不仅推进对生命现象的理解,也为提高人类的健康服务。
DNA同源重组的第一步、也是最关键的一步、是DNA末端降解(End Resection)。DNA末端解降是DNA2、EXO1、及MRN降解DNA双链断裂处的5’-链,切除大约几千个核苷酸,生成一条3’-ssDNA单链。这里,一个长期悬而未决的问题是细胞切除5’-链的几千个核苷酸,但同时保证3’-链的绝对完整。切除DNA末端降解过程用到了一个DNA代谢过程中很重要的核酸酶—DNA2。我们之前的研究发现DNA2核酸酶特异性的切割单链DNA,不切割双链DNA,并且DNA2对5’端和3’端的单链DNA都可以进行高效的切割。考虑到DNA2酶的这个特性,我们就思考DNA末端降解过程中细胞是通过何种机制控制DNA2只切割5’单链DNA而不切割3’单链DNA。过去二三十年,普遍被接受的观点是3’单链DNA是通过 RPA的结合来保护的,但此观点没有确切的实验证据。
CellPress:同源重组主要发生在细胞周期中的什么周期,其对细胞的生物学意义是怎样的?
孔道春教授: 同源重组主要发生在有丝分裂细胞的DNA复制期(S-phase,DNA synthesis)和间期2(G2 phase);大量的DNA同源重组存在与细胞的减数分裂,所以,它是配子形成的必需事件。这是因为同源重组需要从同源模板链上进行DNA拷贝(通常是姐妹染色体),细胞只有在S/G2期存在用于重组的同源模板DNA。如果其它时期进行同源重组的话,由于没有模板链,DNA末端降解后没法进行下一步,而这种DNA结构是很不稳定的,很容易被细胞内的核酸酶攻击,导致大量遗传物质丢失。因此,细胞经过十几亿年的进化,将同源重组安排在了细胞周期的特定时期。
CellPress:我们通常认为RNA聚合酶III的生物学功能主要是什么?在以前的同源重组及其介导的DNA双链断裂修复过程中,RNA聚合酶III是否也被证实发挥相关的生物学作用?
孔道春教授: RNA聚合酶III的生物学功能是合成转运RNA(tRNA),核糖体5S RNA,U6 RNA等。以前,人们不知道RNA聚合酶III会直接参与DNA同源重组及同源重组介导的DNA双链断裂损伤修复。我们首次发现并证明RNA聚合酶III直接参与DNA同源重组及双链断裂损伤修复。
CellPress:通过本研究我们知道RNA聚合酶III的活性对同源重组和DNA双链断裂修复至关重要,那么其活性变化会造成怎样不利影响?
孔道春教授: RNA聚合酶III在同源重组过程中的关键功能是用3’单链DNA作为模板合成RNA,进而形成RNA-DNA杂交链来保护末端切割产生的3’单链DNA。而且,RNA聚合酶III催化的RNA合成过程与DNA末端降解过程又是偶联的。因此,如果RNA聚合酶III的活性降低,则导致DNA末端降解效率降低和同源重组频率降低。同时,由于细胞内还有一些其它非RNA聚合酶III依赖的末端降解途径,如EXO1核酸外切酶催化的5’-链降解,使得末端降解仍能部分进行,这时由于没有RNA聚合酶III催化合成的RNA的保护,生成的3’单链DNA很容易被核酸酶攻击,造成遗传物质丢失。
CellPress:这项研究能够为同源重组领域提供哪些借鉴和帮助?
孔道春教授: 这个研究发现了同源重组过程的一个必需中间体—RNA-DNA杂交链,和一个必需因子—RNA聚合酶III。以前,由于不知道有这样一个必需中间体存在,导致很多重要问题不能解决,如BRCA1、BRCA2等蛋白的真正生化作用机制一直不能完全确定。这个研究使得我们对同源重组机制的理解更上了一层楼,很多之前没法理解的现象可以被解析;后期我们可以围绕RNA-DNA杂交链这个中间体及RNA聚合酶III进行更加深入的同源重组分子机制的研究。
CellPress:您和您的团队接下来的工作重点将会放在哪里?
孔道春教授: 我们后期将围绕RNA-DNA杂交链中间体及RNA聚合酶III进行上下游的的分子机制研究,期待更加深入的理解同源重组机制。
作者简介

孔道春
教授
孔道春,北京大学生命科学学院、北大-清华生命科学联合中心、蛋白质工程与植物基因工程国家重点实验室教授,《DNA Repair》Editorial Board,973项目首席科学家,亚洲冷泉港:“DNA代谢、基因组稳定性及疾病”及“酵母与生命科学”国际会议组结者。我们研究方向:真核细胞DNA代谢及基因组稳定性的机制。具体项目包括:1)真核细胞DNA复制的机理, 包括DNA复制起始及复制叉里的生化反应机制;2)细胞维持DNA复制叉稳定的分子机制;3)DNA同源重组及双链DNA断裂修复机制;4)checkpoint及chromsfork调控机制;5)染色质结构形成机制;6)细胞癌变机制及抗癌药物研发。
相关论文信息
研究成果发表在Cell Press旗下Cell期刊上,点击“阅读全文”。
▌论文标题:
RNA polymerase III is required for the repair of DNA double-strand breaks by homologous recombination
▌论文网址:
https://www.cell.com/cell/fulltext/S0092-8674(21)00091-X
▌DOI:
https://doi.org/10.1016/j.cell.2021.01.048
